

如何建立穩定的腦缺血再灌注損傷模型?關鍵技巧分享
 2025-04-21 17:35:30
2025-04-21 17:35:30
來源/作者:普拉特澤-生物醫學整體課題外包平臺
如何建立穩定的腦缺血再灌注損傷模型由普拉特澤生物為大家總結分享,普拉特澤生物動物實驗平臺專業承接裸鼠成瘤實驗外包、動物造模等動物實驗代做服務,積累專業豐富的實驗操作經驗,腦缺血再灌注損傷決方案,幫助研模型是研究腦卒中病理機制和藥物評價的重要工具。本文將詳細介紹建立穩定可靠的腦缺血再灌注損傷模型的關鍵技巧,包括動物選擇、手術操作要點、質量控制標準和常見問題解究人員提高模型成功率和實驗可重復性。
一、模型建立前的準備工作
1. 實驗動物選擇
品系選擇:
大鼠:首選SD或Wistar大鼠(體重280-320g)
小鼠:C57BL/6(體重22-25g)
年齡控制:選擇12-14周齡成年動物
飼養環境:恒溫(23±1℃)、恒濕(50±10%)、12h/12h光暗周期
適應性飼養:至少3天適應期

2. 主要試劑與儀器
①必備器械:
顯微手術器械套裝
體溫維持系統
激光多普勒血流儀
血氣分析儀
②關鍵試劑:
水合氯醛/異氟烷麻醉劑
肝素鈉溶液
硅膠涂覆尼龍線栓(直徑規格匹配動物體重)
二、標準化手術操作流程(以MCAO線栓法為例)
1. 麻醉與術前處理
麻醉方案:
誘導:4%異氟烷
維持:1.5-2%異氟烷(推薦吸入麻醉)
術前用藥:
阿托品(0.05mg/kg,sc)減少呼吸道分泌物
肝素鈉(50U/kg,ip)預防血栓形成
2. 手術關鍵步驟
頸部正中切口(約1.5cm)
分離頸總動脈(CCA)、頸外動脈(ECA)、頸內動脈(ICA)
ECA遠端結扎并剪斷(形成"殘端")
ICA近端臨時阻斷(微動脈夾)
線栓插入(從CCA分叉處向ICA推進):
▲大鼠:插入深度18-20mm
▲小鼠:插入深度10-12mm
▲固定線栓(結扎CCA近心端)
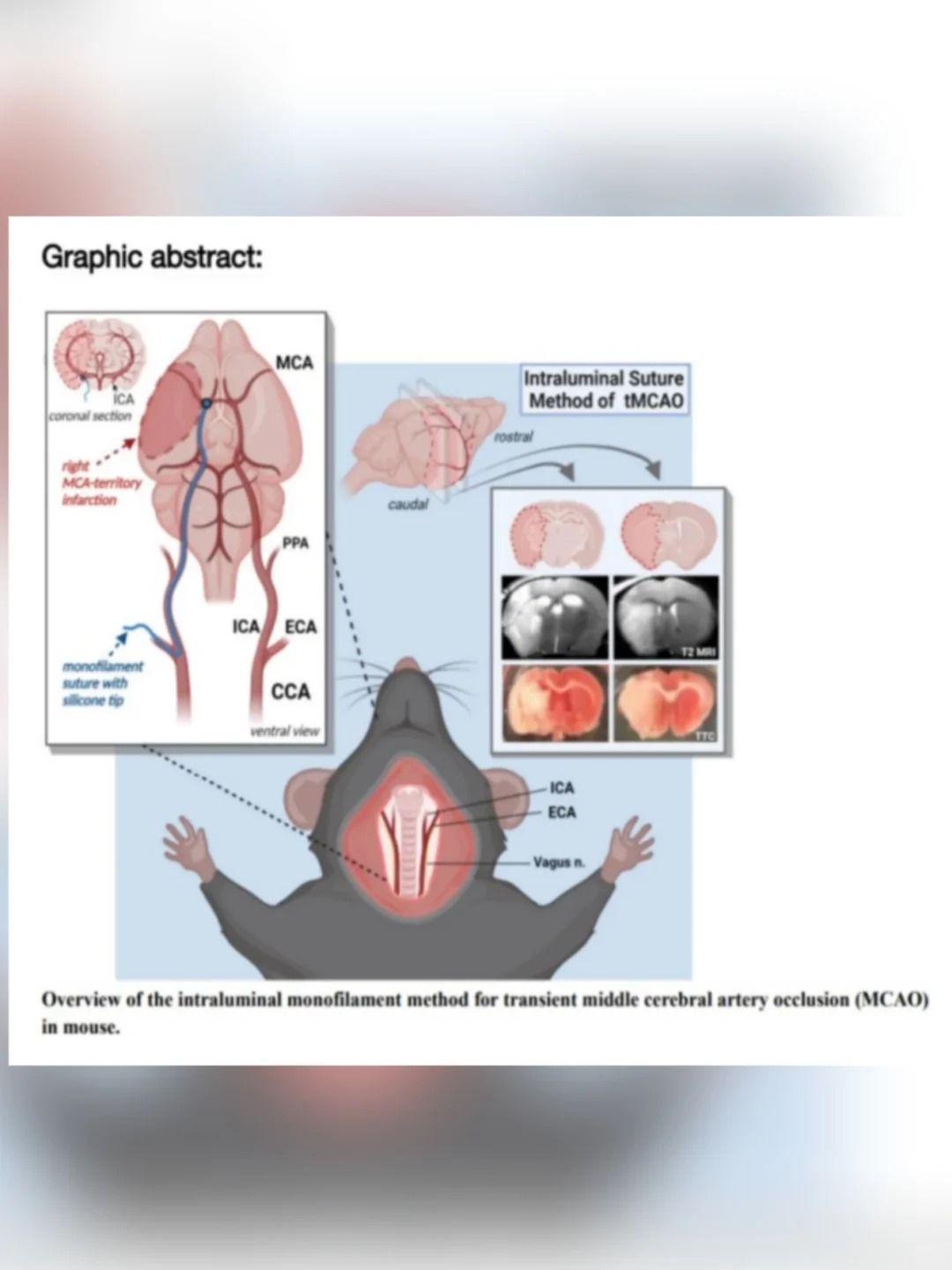
3. 再灌注操作
缺血時間控制:
短暫性缺血:通常60-90分鐘
永久性缺血:不拔出線栓
再灌注技巧:
緩慢拔出線栓(約30秒)
觀察ICA血流恢復(激光多普勒確認)
三、提高模型穩定性的關鍵技巧
1. 血流監測標準化
激光多普勒使用要點:
探頭固定于顱骨(前囟后2mm,右側3mm)
基線血流記錄≥10分鐘
成功標準:血流下降>70%基線
2. 生理參數控制
核心指標:
體溫維持(37±0.5℃)
血氧飽和度(>95%)
動脈血氣(pH 7.35-7.45)
血糖(4-8mmol/L)
3. 線栓選擇與處理
線栓直徑:
●大鼠:0.28-0.30mm
●小鼠:0.20-0.22mm
●硅膠頭端處理:
長度:大鼠0.3-0.4mm,小鼠0.2-0.3mm
烘烤固化(60℃,24h)
四、質量控制與評估標準
1. 模型成功標準
急性期評估(24h):
神經功能評分≥2分(Bederson評分)
TTC染色梗死體積>20%同側半球
2.排除標準:
蛛網膜下腔出血
術中死亡
未達到血流下降標準
2. 常見問題解決方案
問題
①高死亡率 線栓插入過深 調整插入深度,術前訓練
②梗死體積變異大 體溫波動 加強術中體溫監控
③再灌注失敗 血栓形成 優化肝素用量,線栓硅膠化處理
④神經評分不一致 評估主觀性 采用盲法,多人評分
五、術后護理與長期觀察
1. 術后管理要點
鎮痛處理:布托啡諾(0.1mg/kg,sc)
補液支持:生理鹽水(2ml,sc)
飲食調整:軟食喂養3天
2. 長期觀察指標
行為學測試時間窗:
急性期:1-3天
亞急性期:7-14天
慢性期:28天
推薦測試:
改良神經嚴重程度評分(mNSS)
轉角試驗
足失誤測試
六、模型驗證與優化建議
1. 多模態驗證
影像學驗證:
MRI(DWI序列檢測早期缺血)
PET(代謝活性評估)
分子水平驗證:
缺血半暗帶標志物(HIF-1α)
凋亡相關蛋白(Caspase-3)
2. 技術創新方向
光化學誘導法:更精確的梗死定位
內皮素-1模型:無創誘導
微創技術:血管內介入法
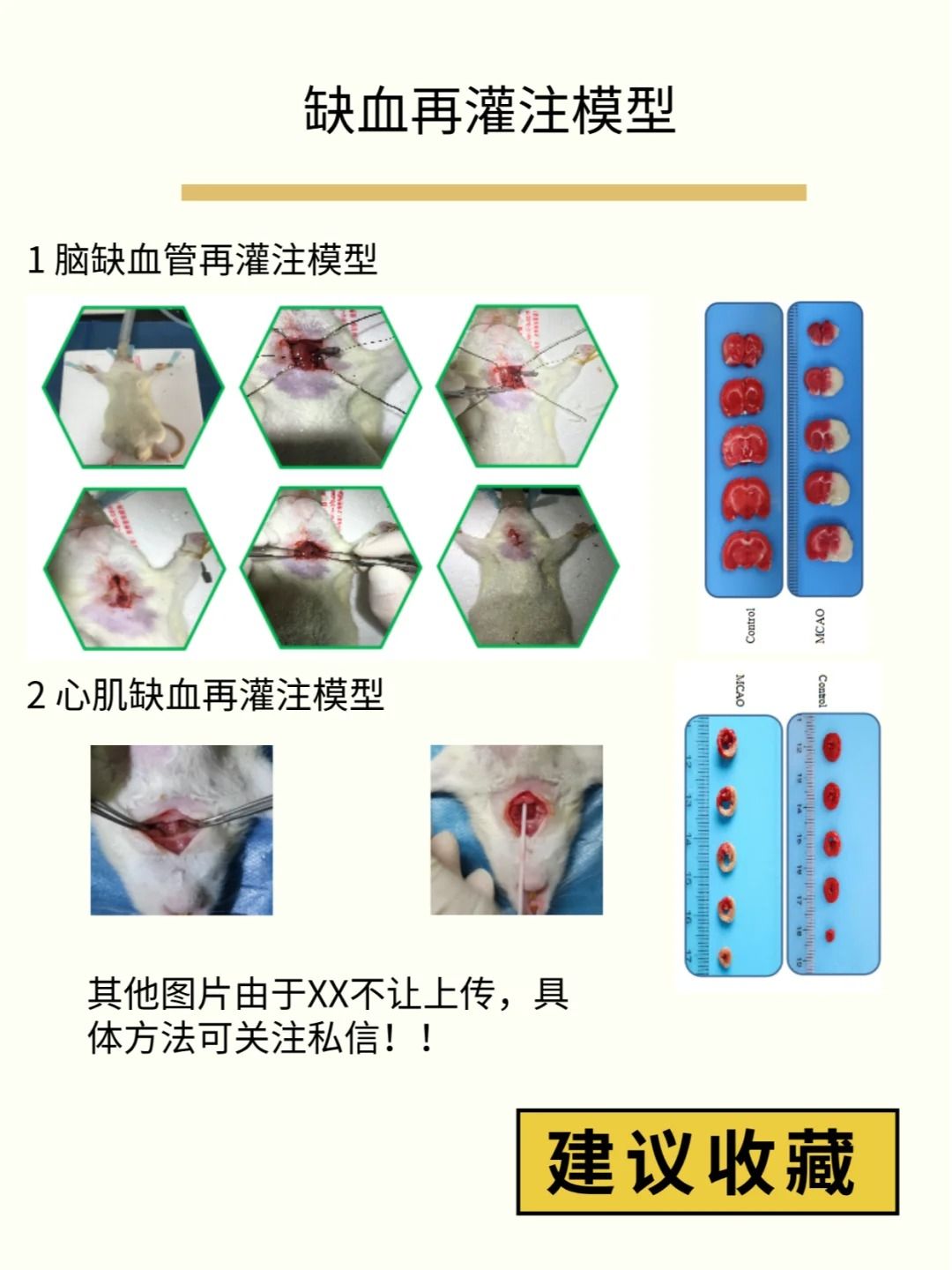
建立穩定的腦缺血再灌注損傷模型需要精細的手術操作、嚴格的參數控制和系統的質量評估。通過標準化操作流程和關鍵技巧的應用,可顯著提高模型的成功率和可重復性,為腦卒中研究提供可靠的工具。
好啦,穩定的腦缺血再灌注損傷模型咱們就介紹完啦,如果您也對腦缺血再灌注損傷模型感興趣或正在準備腦缺血再灌注損傷模型的話歡迎隨時咨詢普拉特澤生物、或者手動掃碼~

