

ChIP實驗全流程深度解析:從樣本制備到結果驗證的專業指導
 2025-07-10 17:53:04
2025-07-10 17:53:04
來源/作者:普拉特澤-生物醫學整體課題外包平臺
ChIP實驗全流程深度由普拉特澤生物分子檢測平臺總結分享,分子檢測平臺為廣大科研實驗人員提供ChIP實驗外包,先一起來學習從樣本制備到結果驗證的全流程
一、ChIP實驗概述與原理
染色質免疫共沉淀(Chromatin Immunoprecipitation, ChIP)是研究蛋白質與DNA相互作用的關鍵技術,廣泛應用于轉錄因子結合位點、組蛋白修飾等表觀遺傳學研究領域。
核心原理:通過特異性抗體富集與目標蛋白結合的DNA片段,結合高通量測序(ChIP-seq)或qPCR分析,精確定位蛋白-DNA相互作用位點。
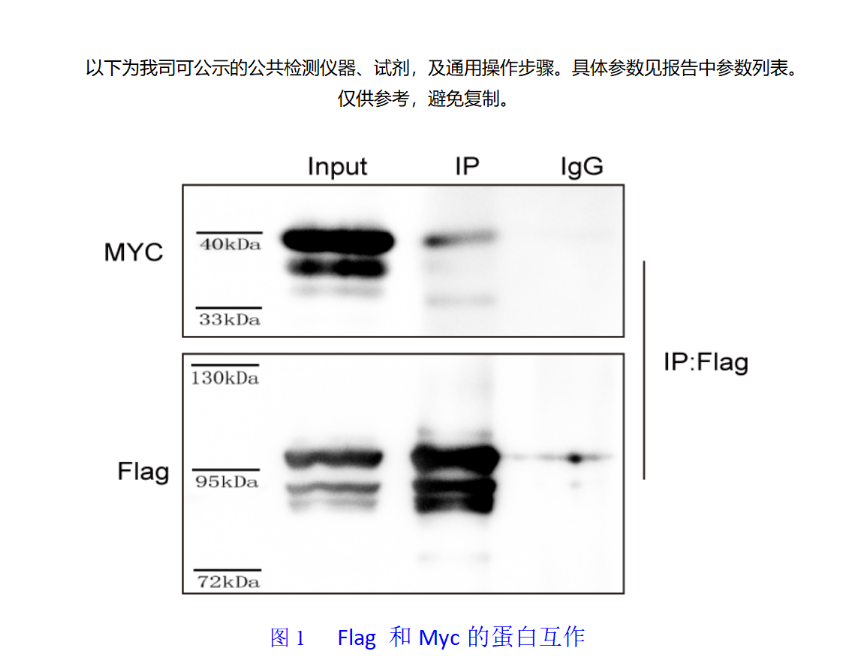
圖1
二、樣本制備關鍵步驟與優化策略
2.1 細胞培養與處理
細胞狀態控制:確保細胞處于最佳生長狀態(對數生長期)
交聯條件優化:1%甲醛室溫交聯10-15分鐘(根據細胞類型調整)
終止反應:使用終濃度0.125M甘氨酸終止交聯
2.2 染色質片段化技術
超聲破碎參數:
Bioruptor?推薦條件:30秒ON/30秒OFF,15-20個循環(4°C)
片段大小目標:200-500bp(需電泳驗證)
酶解法(Micrococcal Nuclease)替代方案:適用于組蛋白修飾研究
2.3 質量控制要點
片段大小檢測:1.5%瓊脂糖凝膠電泳
濃度測定:Nanodrop或Qubit定量(建議≥50μg/反應)
三、免疫沉淀核心操作技巧
3.1 抗體選擇標準
驗證過的ChIP級抗體優先(查閱CST或Abcam數據庫)
陰性對照:同型IgG對照
陽性對照:H3K4me3(活躍啟動子標記)或H3K27me3(抑制性標記)
3.2 磁珠預處理
Protein A/G磁珠比例:根據抗體亞型優化(通常1:1混合)
封閉步驟:0.5% BSA+0.2mg/ml鮭魚精DNA預處理1小時
3.3 結合條件優化
孵育時間:4°C過夜(12-16小時)
洗滌緩沖液配方:
低鹽:20mM Tris-HCl(pH8.0), 150mM NaCl
高鹽:20mM Tris-HCl(pH8.0), 500mM NaCl
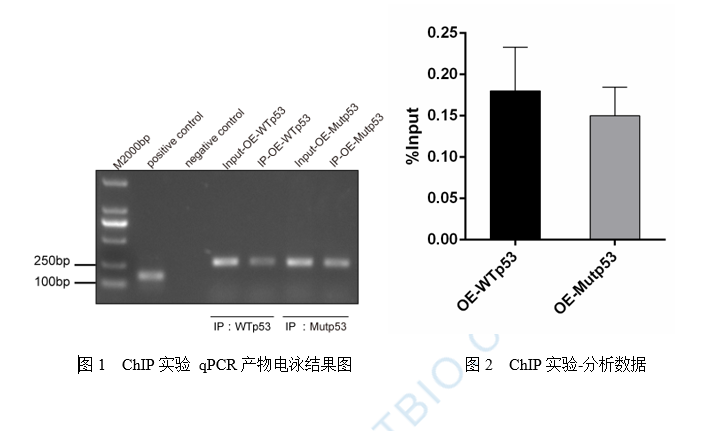
圖2
四、DNA純化與質量檢測
4.1 解交聯條件
65°C水浴6小時(含5M NaCl和10mg/ml蛋白酶K)
4.2 純化方法選擇
酚-氯仿抽提法:回收率高但操作復雜
硅膠柱純化法:推薦使用QIAquick PCR Purification Kit
4.3 質量評估指標
濃度要求:≥1ng/μL(ChIP-seq)
完整性檢測:Agilent 2100 Bioanalyzer(避免RNA污染)
五、下游分析技術選擇
5.1 ChIP-qPCR驗證
引物設計原則:
長度18-22bp,Tm值60±2°C
擴增片段80-150bp
數據分析方法:ΔΔCt法計算富集倍數
5.2 ChIP-seq文庫構建
末端修復:T4 DNA聚合酶/Klenow片段混合系統
接頭連接:推薦使用NEBNext Ultra II DNA Library Prep Kit
六、常見問題解決方案
6.1 低信號處理策略
抗體滴定實驗:測試1-10μg抗體用量
增加起始材料:建議≥1×10^7細胞/反應
6.2 高背景解決方案
增加洗滌嚴格度:加入0.1% SDS或LiCl洗滌
DNase處理磁珠:去除非特異性DNA結合
還有更多疑問建議或需要ChIP實驗外包的同學可點擊“普拉特澤”了解咨詢哦,提供原始數據,死磕真實實驗!

