相信大家對單細胞都不陌生,就算沒做過,也肯定聽說過。很多做單細胞包發文的公司會告訴你“現在做單細胞就只能發個五六分了,不像以前好發”。這是普遍現象,但不是絕對現象。單細胞發文的新手福利期已過,SCI和標書的評委們對這樣的技術手段司空見慣,因此逐漸對研究的深度及研究的價值提出了更高要求。如果要發文章,單細胞是一個不錯的捷徑;但如果要中“國自”,僅有單細胞,絕不足夠。
請看國家自然科學基金-醫學科學部對通訊評審的評閱要求——醫學科學部將科學研究的“原創性”“真實可靠性”“科學意義和價值”作為項目評價的主要原則和標準,遴選出“具有真正創新思想”的研究項目和優秀人才,鼓勵研究人員潛心探究、攻克具有“挑戰性和變革意義的疑難科學問題”,培育并形成“十年磨一劍”的學術氛圍。
那么如何提升單細胞測序技術的發文水平,為國自課題的申報助力呢?今天小編給大家提供一個研究案例,來自2022年10月22日,上海復旦大學陳曉軍/趙冰合作課題組在《Nature Communications》期刊上發表的關于人子宮內膜樣癌的起源和病理過程的研究。該研究團隊通過單細胞轉錄組學分析繪制了人類正常子宮內膜向子宮內膜癌轉變過程中不同細胞亞群細胞的動態圖譜。
論文鏈接:https://doi.org/10.1038/s41467-022-33982-7
子宮內膜癌(EC)是繼宮頸癌后第二常見的婦科惡性腫瘤之一,是發生于子宮內膜的一種上皮性惡性腫瘤,子宮內膜樣癌(EEC)是EC的主要病理特征。在EEC腫瘤發生中,子宮內膜缺乏孕酮的保護,長期暴露于雌激素刺激下發生惡性增殖,正常子宮內膜逐漸發展為非典型子宮內膜增生(EEC癌前階段)。關于EEC來源和正常子宮內膜向EEC演化過程中細胞亞群動態變化尚不清楚。因此,該研究通過單細胞轉錄組測序分析確定EEC的來源及發生過程中細胞亞群的動態變化,為子宮內膜癌的診斷和治療提供新的方向。一、EEC很可能來源于子宮內膜上皮細胞而非基質細胞
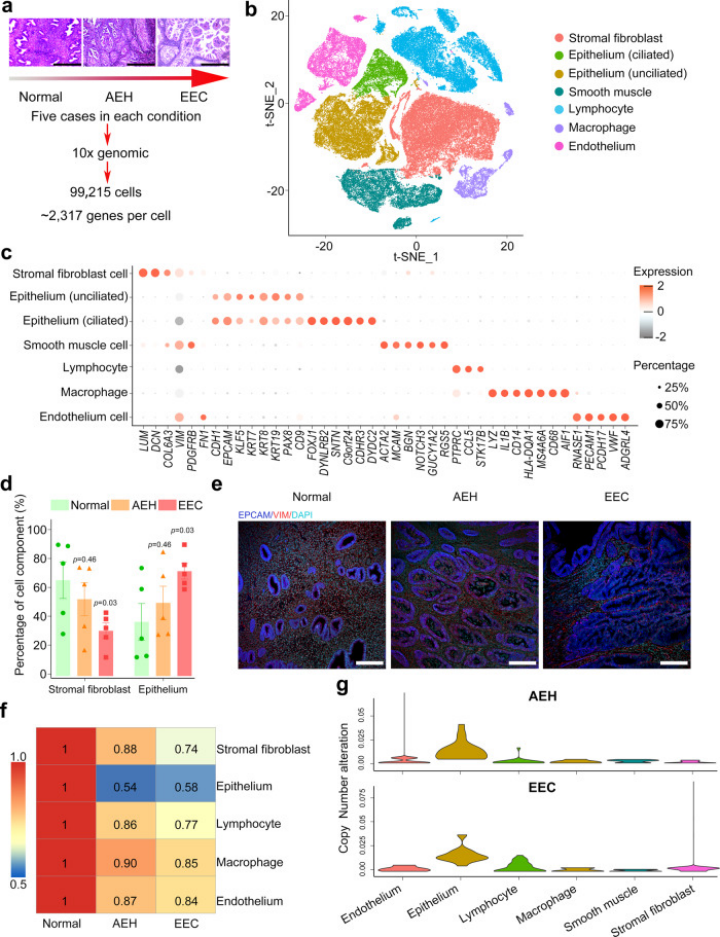
該研究共收集了99,215個細胞,每個細胞產生了2317個檢測基因的的中位數,聚類分為7個細胞簇。對比不同子宮內膜病理階段(AEH、EEC)和正常人類子宮內膜樣本細胞比例發現:來自不同病理階段的子宮內膜基質纖維細胞與正常子宮內膜表現出高度相似性,而上皮細胞存在顯著差異,表明EEC很可能來源于子宮內膜上皮細胞而非基質細胞。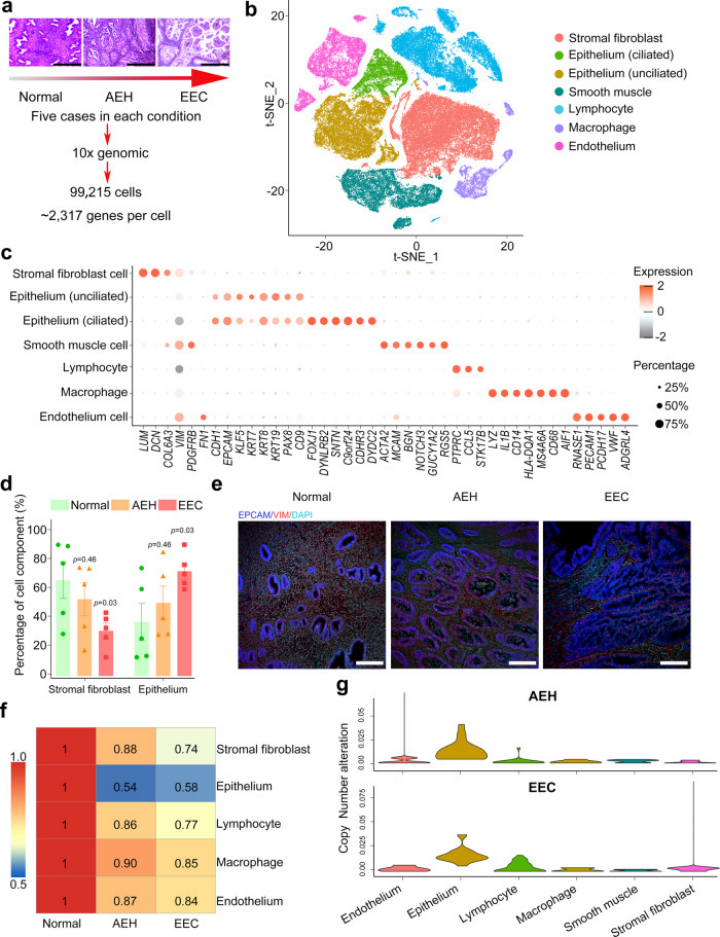
二、無纖毛上皮細胞亞群的出現是子宮內膜癌發生的關鍵步驟
通過研究RNA速度分析預測細胞的發展軌跡發現無纖毛的腺細胞到致癌亞群有強烈的方向性流動,表明致癌亞群的來源最可能是無纖毛的腺細胞,充分證明AEH為EEC的前驅病變。表明獨特的無纖毛上皮細胞亞群的出現是子宮內膜癌發生的關鍵步驟。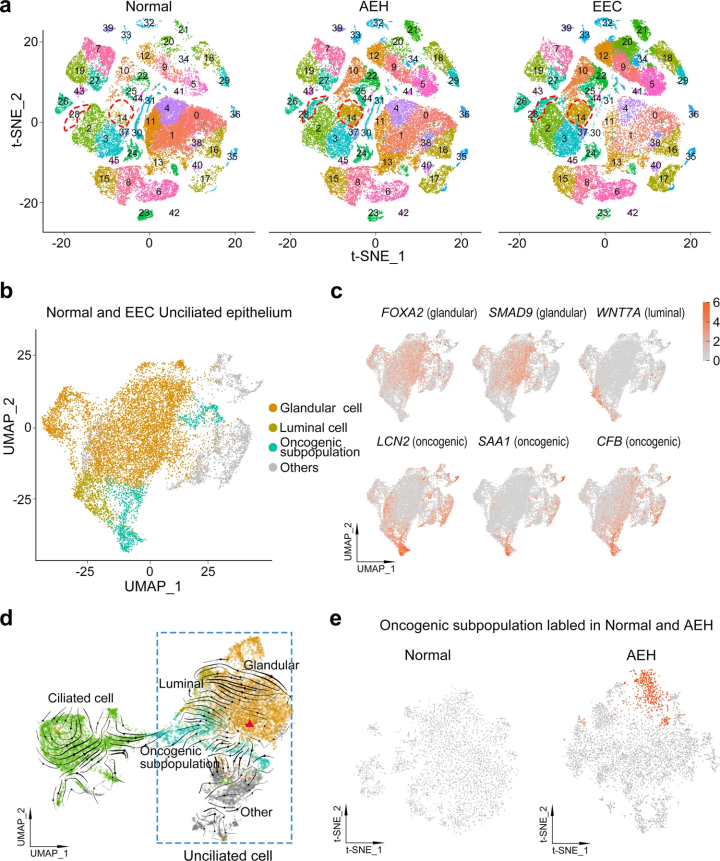
三、LCN2+SAA1/2+上皮細胞亞群是EEC形成的早期標志物
該研究通過對比子宮內膜病變不同階段的免疫熒光染色證實,EPCAM + /LCN2 +和SAA1/2細胞出現在AEH和EEC樣本中,但在正常子宮內膜中未出現,因此LCN2+/SAA1/2+上皮細胞亞群是EEC的早期標志物。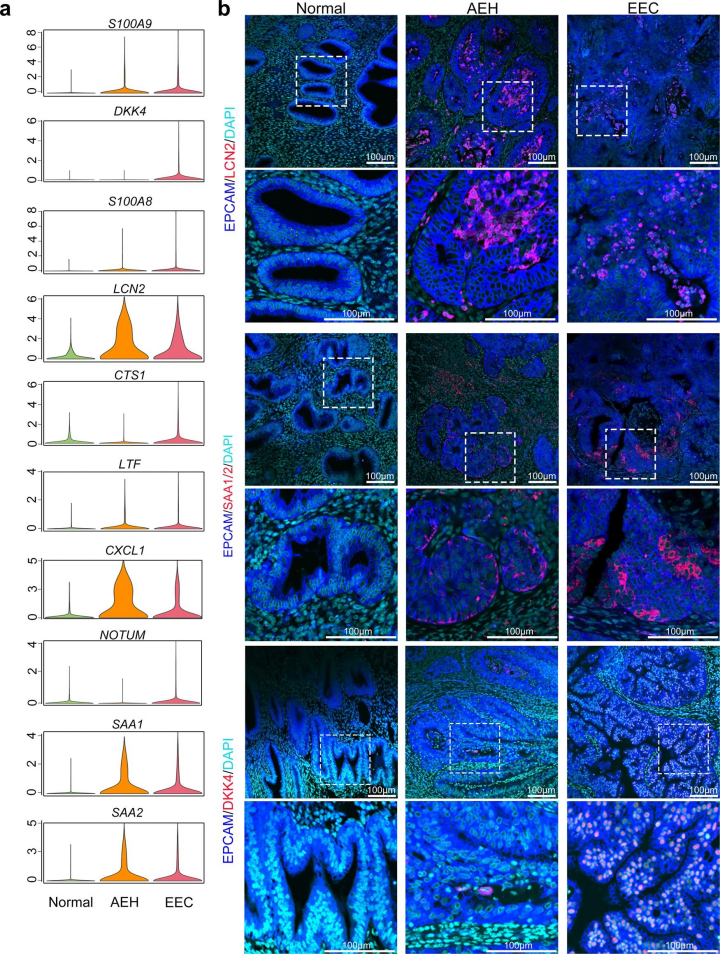
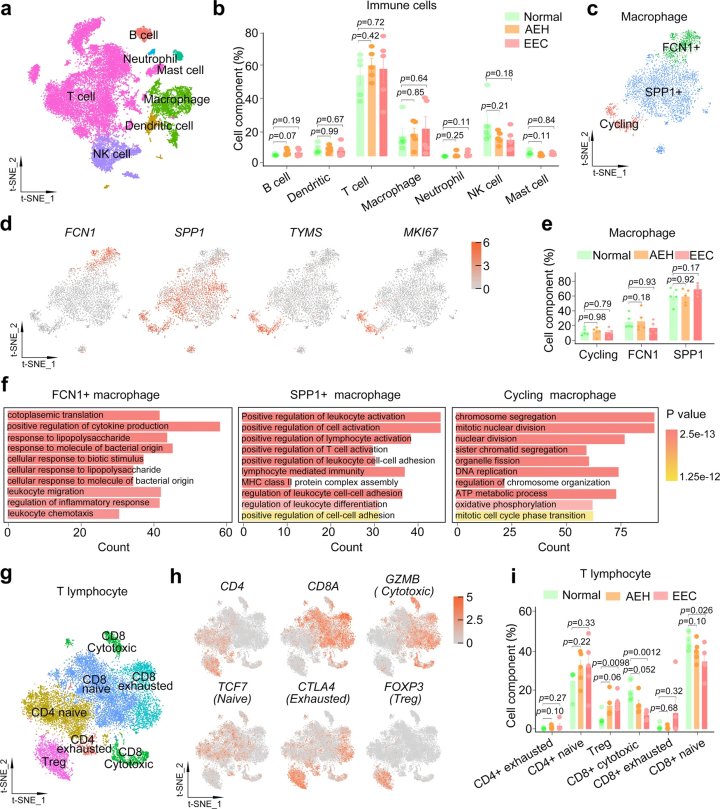
對比三個病理階段免疫細胞聚類發現:EEC中細胞毒性CD8 T細胞和初始CD8 T淋巴細胞的比例顯著降低,而與免疫抑制相關的FOXP3+CD4 Treg 淋巴細胞比例增加,表明免疫逃逸機制在EEC的發生過程中發揮著重要作用。
全文提煉
該研究通過對正常子宮內膜、AEH和EEC進行單細胞轉錄組學測序分析,揭示了EEC起源于無纖毛的腺上皮細胞和LCN2 + SAA1/2+細胞的出現是子宮內膜腫瘤形成的一個重要標志。描繪了內膜癌發生過程中腫瘤微環境和細胞亞群的動態變化,根據CD8淋巴細胞群比例下降,CD4 Treg細胞群的比例增加,推測免疫逃逸與子宮內膜癌的發生密切相關,為內膜癌細胞起源、早期診斷及臨床治療提供了新的線索方向。
單細胞測序指在單個細胞水平上進行基因組、轉錄組或表觀組測序的技術,近幾年單細胞測序技術取得飛速發展及矚目成果,越來越多的高水平文章橫空出世,在腫瘤、微生物、免疫學和神經科學等領域正在慢慢得到應用。普拉特澤生物已搭建全新單細胞多組學測序分析平臺,擁有過硬的實驗技術團隊和豐富的項目經驗可以為廣大科研工作者和臨床工作者提供更為優質的單細胞多組學服務,包括:單細胞轉錄組,單細胞轉錄組+V(D)免疫組聯合分析,單細胞ATAC以及單細胞ATAC+mRNA聯合分析。此外我們還提供利用Feature Barcoding的單細胞表面蛋白檢測,及單細胞表面抗原特異性檢測等服務。服務案例:

好,本期的精品導讀就到這里
我們下期再見~
流式檢測|病理檢測|動物模型|實驗服務|分子操作|免疫相關檢測免費熱線:18570028002
官網:http://www.zjgzfxx.com


 2023-06-30 14:48:14
2023-06-30 14:48:14







