

QPCR檢測實驗詳細的步驟與報告(二)
 2024-01-04 17:05:09
2024-01-04 17:05:09
來源/作者:普拉特澤-生物醫學整體課題外包平臺
普拉特澤生物為廣大生命科學研究人員提供QPCR檢測實驗,可根據實方案的要求選擇不同的檢測方法,本文就跟大家一起繼續闡述QPCR檢測實驗詳細的步驟與報告。
一、實驗目的
通過QPCR實驗技術定量檢測基因表達量。
二、實驗樣品及分組
1. 實驗樣本

備注:包括干預細胞用的相關試劑均按實驗樣品登記,每行登記一個或一組獨立樣品。
2 .實驗分組
細胞: SH-SY5Y
分組:
常規培養條件:完全培養基,95%空氣+5%二氧化碳;
OGD培養條件:無糖Earle液,95%氮氣+5%二氧化碳處理4h,復氧復糖24h
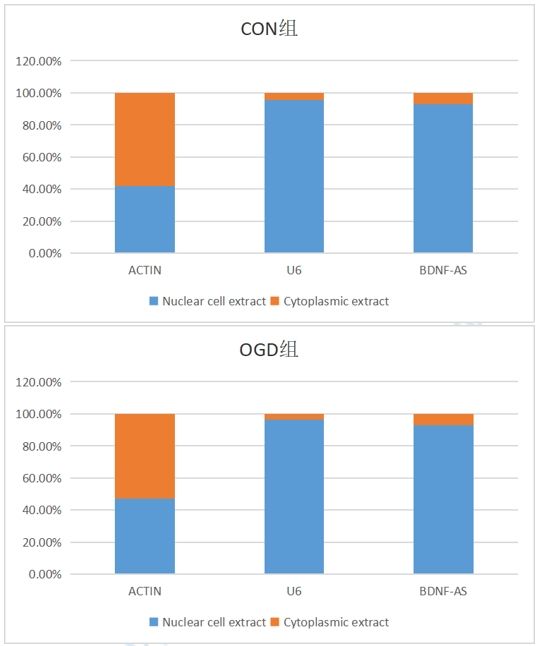
指標:1、核質分離后檢測lncRNA BDNF-AS(NR_002832.2)
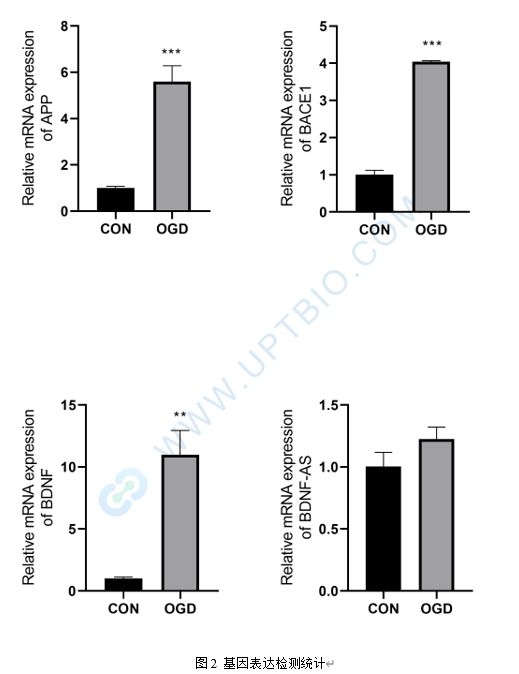
2、提取總RNA檢測BDNF(Gene ID: 627)、APP( Gene ID: 351)、BACE1( Gene ID: 23621)、BDNF-AS的表達(默認最長的轉錄本)
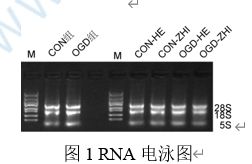
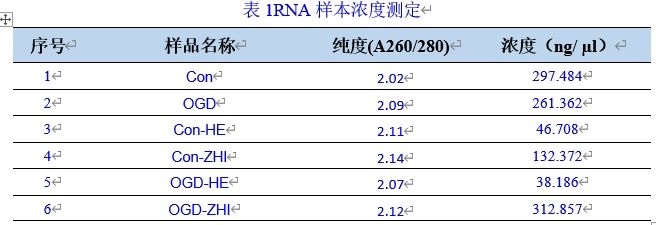
三、實驗結果
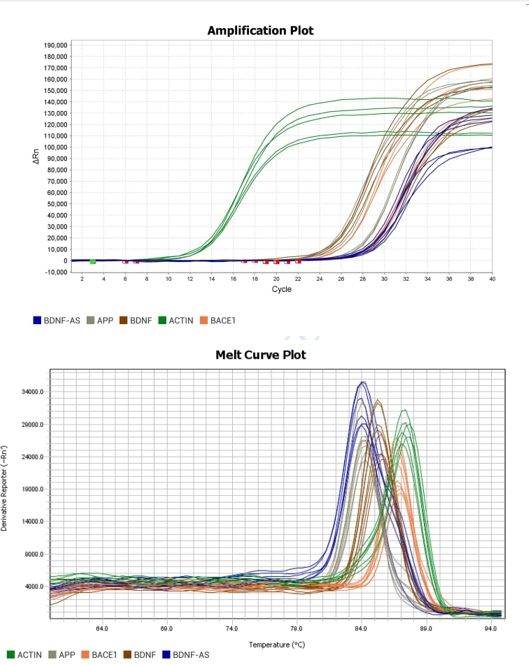
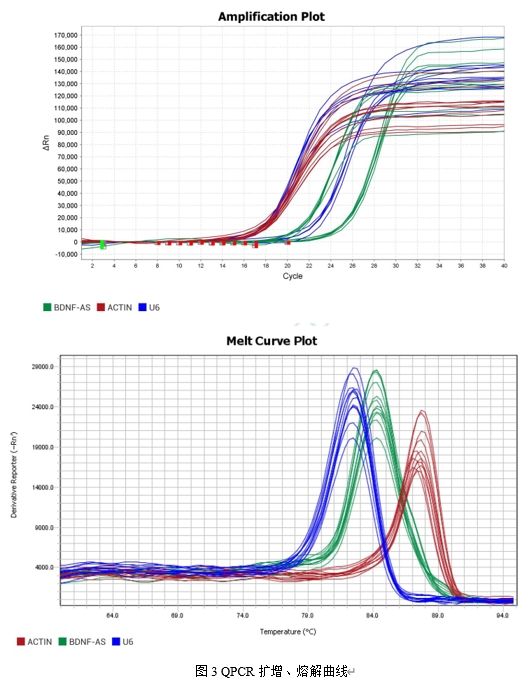
四、實驗材料
1.主要實驗儀器
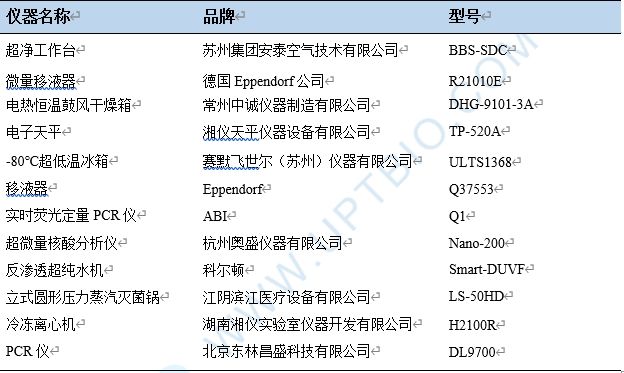
2.主要實驗試劑及耗材

五、實驗原理
QPCR技術,是指在PCR反應體系中加入熒光基團,利用熒光信號累積實時監測整個PCR進程,最后通過標準曲線對未知模板進行定量分析的方法。根據熒光信號的變化能夠實時檢測PCR擴增反應中每一個循環擴增產物量的變化,通過Ct值和標準曲線的分析就能對起始模板進行定量分析。
六、實驗步驟
1.引物設計

2.樣品前期處理
向細胞樣本中加入500 μl Trizol。
3. RNA提取
(1) 向加有Trizol的1.5 ml EP管中加入100 μl氯仿,震蕩混勻后,靜置5 min,在12000 rpm,4度離心10 min。
(2) 從離心機中取出1.5 ml EP管,再將上層無色透明的水相層吸入到另一干凈的1.5 mlEP管中。(樣品會分為三層:下層有機相層,中間層和上層的水相層,RNA位于上層水相中。)加入等體積的異丙醇,上下輕輕顛倒混勻之后,靜置10 min,再12000 rpm,4度離心10 min。
(3) 離心之后可在EP管壁或管底看到膠狀沉淀出現,沉淀就是要提取的RNA。小心棄去上清,不要將沉淀倒掉了。
(4) 用1 ml 75℅乙醇對RNA沉淀進行洗滌。然后于4℃ 7000 rpm離心5分鐘,將上清盡量去除干凈。
(5) 室溫靜置干燥,大約干燥5~10分鐘即可。(不要真空離心干燥,過于干燥會導致RNA的溶解性大大降低)。所有EP管中加入25 μl 的DEPC H2O,用槍頭吹打幾次,使RNA充分溶解,-80℃保存。
(6) RNA濃度檢測:使用核酸蛋白檢測儀檢測RNA濃度。
4.RNA濃度及純度測定
(見實驗結果部分)
5.逆轉錄PCR
1. 按以下組份分別配制逆轉錄反應液:

2.cDNA立刻進行實驗或者置于4℃保存。
六、實時熒光定量PCR反應
1. 反應體系的配置

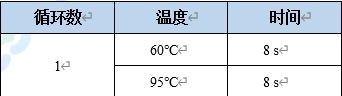
2.反應條件設置:
擴增程序:

3.熔解程序
如果想知道更多關于QPCR實驗,以及QPCR的理論視頻和實操課程,也可以聯系我們:18570028002或微信pulateze666會把這些資料發送給大家哦。

