

Autophagy教你怎樣做自噬的泛素化調節
 2022-02-08 12:00:21
2022-02-08 12:00:21
來源/作者:普拉特澤-生物醫學整體課題外包平臺
SQSTM1/p62這個很熟悉吧?
做自噬研究的小朋友應該都對它十分了解了。
不熟悉的小朋友請往下看:

SQSTM1/p62作為信號樞紐和選擇性自噬受體,參與包涵體的形成和自噬過程。
自噬途徑的許多關鍵成分都經歷了泛素化修飾,而這種修飾已被證明在自噬調控中發揮重要作用。
SQSTM1的泛素化也會發生,并且在泛素脅迫下顯著升高。泛素化已經被證明可以調節SQSTM1的活性。
前期研究發現了幾種重要的泛素連接酶,根據它們的泛素化位點,抑制或促進SQSTM1的功能,我已經幫大家整理好了:

TRIM21
E3泛素連接酶TRIM21:直接與PB1結構域內的lysine 7 (K7)位點SQSTM1相互作用并泛素化。這種泛素化作用顯著削弱SQSTM1的寡聚化,進而抑制了其隔離功能。
RNF166
E3連接酶RNF166:催化K29,K33,K91,和K189位點上的多聚泛素化。RNF166介導的泛素連接酶活性促進SQSTM1在細胞內細菌的外食性降解中的作用。
NEDD4
E3泛素連接酶NEDD4:與SQSTM1相互作用并泛素化以實現包涵體自噬。
Cullin 3
KEAP1-CUL3 (cullin 3):在其UBA結構域的K420處泛素化SQSTM1,以增強SQSTM1的隔離活性和自噬降解。K420的泛素化可能會破壞二聚化,從而釋放SQSTM1識別多泛素化載體的能力以進行選擇性自噬。泛素脅迫誘導K420的泛素化,從而提高大體積和選擇性自噬的通量。
以上都是泛素化酶對SQSTM1的作用。但目前,SQSTM1特異性的去泛素化酶還未被鑒定出來。
那么,本文的主角

就要出場啦!

看表情包干嘛?一起愣著,別學習啊!

本文高光:
1. USP8(泛素特異性肽酶8)直接與SQSTM1相互作用并去泛素化。優先去除SQSTM1中賴氨酸11 (K11)連接的泛素鏈。
2. USP8主要在其UBA域內K420位點去泛素化SQSTM1。
3. USP8抑制了SQSTM1野生型細胞的自噬流,但抑制了其突變體K420的自噬流。
結論:
USP8通過在K420位點去泛素化SQSTM1,成為自噬的負調控因子。

速度看fig(s)~
Fig1:USP8與自噬受體SQSTM1相互作用:
為何選擇USP8與SQSTM1作為研究對象?
SQSTM1被鑒定為非典型蛋白激酶C亞型的支架蛋白,定位于溶酶體靶向的內吞體。推測內含體相關的去泛素化酶可能調節SQSTM1的泛素化。USP8/UBPY同樣位于內吞體,可調節包括表皮生長因子(EGF)受體在內的許多蛋白質的內體分選。因此推測USP8可能與SQSTM1相互作用并調節其泛素化。
作者通過co-ip、GST pulldown、截斷式co-IP、免疫熒光共定位等方式,結果都指向USP8與自噬受體SQSTM1有結合關系。


Fig2:USP8在體外和體內均能去泛素化SQSTM1:
考慮到USP8是一種去泛素化酶,接下來作者確定USP8是否在體內和體外都可以作為去泛素酶作用于SQSTM1的去泛素化。體內外實驗都驗證了USP8顯著降低了SQSTM1泛素化的水平(圖2a、b)。
后續實驗觀察到USP8能夠減少蛋白酶體抑制和熱休克等應激條件下脅迫條件誘導的SQSTM1的泛素化(圖2D)。泛素化的SQSTM1,連同泛素化的載體,不斷被招募到生長中的自噬體中進行溶酶體降解。在基礎條件下,細胞中幾乎沒有被泛素化的SQSTM1。在BafA1(一種通過阻斷自噬體/溶酶體融合來抑制自噬的抑制劑)處理的MEF中敲除內源性USP8,顯著增強了內源性SQSTM1的泛素化種類(圖2E)。這些結果表明USP8是一個SQSTM1去泛素酶。

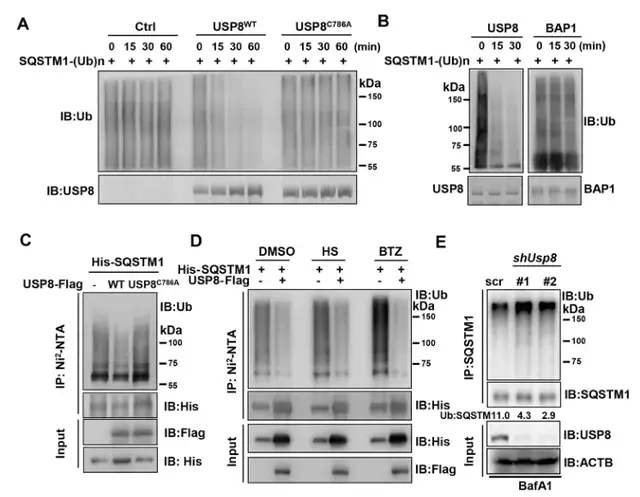
Fig3:USP8優先從SQSTM1中去除k11連接的泛素鏈:
冷知識:泛素蛋白本身攜帶7個賴氨酸殘基,已經鏈接到底物蛋白上的泛素分子的賴氨酸殘基可以繼續發生泛素化修飾,形成泛素鏈。據報道,SQSTM1可被K29、K33、K48和K63連接的多聚泛素鏈修飾。而USP8已被證明可以去除K48、K63、K11和K6連接的泛素鏈。
但作者的結果證實:USP8可以顯著抑制WT和K11泛素鏈的泛素化,較小程度上抑制K48和K63泛素化,對其他的泛素鏈無影響(圖3a)。
在敲除USP8的細胞中,只有K11鏈接的泛素鏈中SQSTM1泛素化顯著上調(圖3b),而USP8敲低并沒有增加細胞中內源性SQSTM1的K63和K48連接的多泛素化(圖3c)。
得出結論,USP8會優先從SQSTM1中去除K11鏈接的泛素綴合物。

Fig4:USP8主要在K420位點去泛素化SQSTM1:
前期質譜分析發現SQSTM1上有多個泛素化位點,包括PB1和UBA結構域內的賴氨酸殘基。接下來作者想判斷SQSTM1的哪些賴氨酸殘基可能受到USP8的影響。有報道稱,UBA結構域中的K420殘基是SQSTM1上的主要泛素化位點。K420的泛素化增強了SQSTM1的隔離活性和選擇性自噬。因此,作者開始研究USP8對K420泛素化的影響。
與野生型SQSTM1相比,SQSTM1K420R突變體上附著的HA-Ub數量顯著減少,但USP8過表達對SQSTM1K420R突變體的泛素化沒有明顯影響。在敲除USP8的細胞中,只有K11鏈接的泛素鏈中SQSTM1泛素化顯著上調(圖4a)。正如預期的那樣,USP8過表達對K48或K63連接的SQSTM1K420R的泛素化沒有顯著影響。
KEAP1 (kelch-like ECH-associated protein 1)最近被證明在K420處泛素化SQSTM1,以增強SQSTM1的螯合活性和自噬降解。作者試圖確定USP8是否與KEAP1競爭SQSTM1在K420位點的泛素化。USP8過表達抑制了KEAP1過表達引起的野生型SQSTM1的泛素化作用。這種效應在SQSTM1K420R突變體中沒有觀察到(圖4c)。因此,USP8拮抗KEAP1使SQSTM1在K420位點泛素化。總的來說,這些結果表明USP8主要去除SQSTM1在K420位點的泛素化。


Fig5:USP8抑制SQSTM1的自噬降解:
有報道稱,SQSTM1的K420處泛素化可增強SQSTM1的隔離活性和自噬降解。前面已經驗證了USP8在K420殘基上去泛素化SQSTM1。作者推斷USP8可能有調控SQSTM1的自噬降解的作用。
通過過表達USP8和敲降,還有分析SQSTM1蛋白的半衰期,作者發現USP8在維持SQSTM1蛋白的穩定性中發揮了關鍵作用。而SQSTM1的降解主要是通過自噬介導的,因此自噬途徑的破壞會導致細胞中SQSTM1蛋白的積累。
但USP8敲除并沒有導致自噬缺失的ATG7-/- mef中SQSTM1蛋白水平的降低。這些結果表明USP8可以保護SQSTM1免受自噬降解。

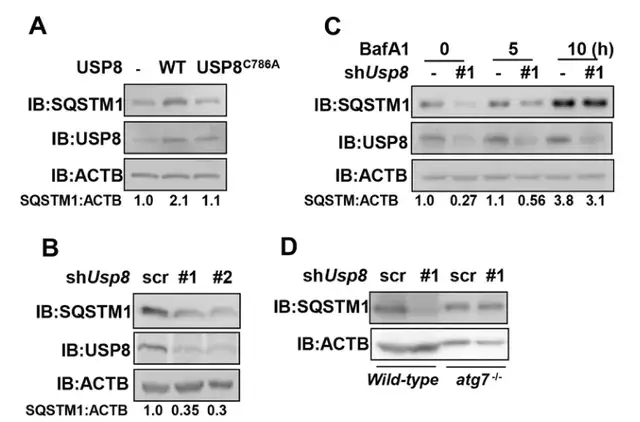
Fig6:USP8負調控自噬:
SQSTM1在其UBA域的K420位點泛素化增強了SQSTM1介導的泛素化載體招募到自噬體進行降解。SQSTM1是一種眾所周知的選擇性自噬底物,SQSTM1的減少被認為是自噬通量增加的指標。USP8在K420位點去泛素化SQSTM1并抑制其自噬降解,提示USP8可能在自噬小體的形成和自噬通量中發揮重要作用。
場外:BafA1可阻止自噬體-溶酶體融合,隨后導致LC3-II的積累,它與自噬體膜緊密結合,并作為自噬的標志。
BafA1導致了LC3-II的累積,過表達USP8降低了LC3-II的累積(圖6a)。敲低USP8,細胞中LC3-II的水平升高(圖6b)。而在硼替佐米處理后,USP8敲除的HeLa細胞比對照組的細胞產生了更大的SQSTM1聚集物(圖6c)。USP8敲低顯著增加了自噬溶酶體的形成,這表明USP8敲除顯著增加了自噬溶酶體的形成(圖6d)。總的來說,這些結果表明USP8是基礎自噬的負調控因子。
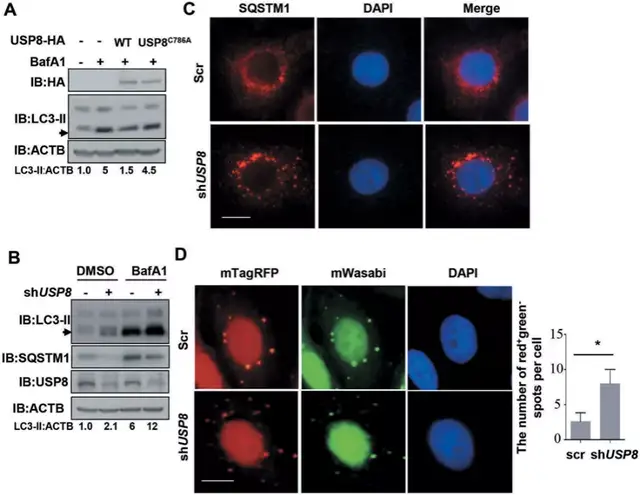
Fig7:USP8通過直接去泛素化SQSTM1的K420來調節SQSTM1的降解和自噬:
自噬的激活可以誘導SQSTM1降解,USP8可能通過調節其他底物影響SQSTM1降解和自噬。接下來,作者嘗試研究USP8是否通過在K420位點去泛素化SQSTM1來影響SQSTM1蛋白水平和自噬。
敲除USP8對sqstm1?/-mef中的LC3-II水平無顯著影響(圖7a);而USP8過表達并沒有明顯改變這些細胞中SQSTM1K420R突變體中LC3-II的水平。這些結果表明,USP8通過在K420使SQSTM1去泛化來調節SQSTM1的活性和自噬。

你看懂了嗎?
沒看懂沒關系,先收藏起來
等到下次寫標書的時候
再好好參考
我們下期再見~

