

免疫熒光染色實驗方法【深入解析與操作指南】
 2024-07-09 18:00:27
2024-07-09 18:00:27
來源/作者:普拉特澤-生物醫學整體課題外包平臺
免疫熒光染色實驗,作為細胞生物學和免疫學研究中的重要工具,為我們提供了觀察和研究細胞內抗原表達、定位和分布的有效手段。免疫熒光染色實驗方法由普拉特澤生物為大家總結分享,普拉特澤生物組織染色實驗平臺專業承接冰凍切片實驗外包、Masson染色等組織染色實驗代做服務,積累專業豐富的實驗操作經驗。本文將為您詳細介紹免疫熒光染色實驗的基本步驟和注意事項,幫助您更好地理解和操作這一實驗技術。
丨丨丨我們繼續從原理進行闡述
▲實驗原理
免疫熒光染色實驗基于抗原-抗體特異性結合的原理,結合熒光標記技術,使得抗原在細胞或組織中的位置和數量能夠被直觀、準確地檢測和量化。在實驗中,特異性抗體與待檢樣本中的抗原結合,隨后與熒光染料標記的二抗結合,形成抗原-抗體-熒光復合物。在熒光顯微鏡下,這些復合物會發出特定的熒光信號,從而實現對抗原的定位和定量檢測。
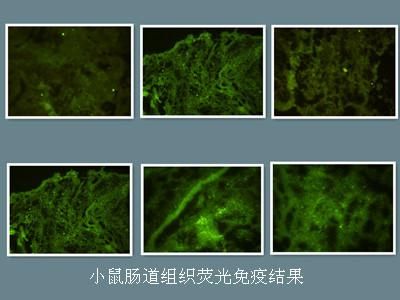
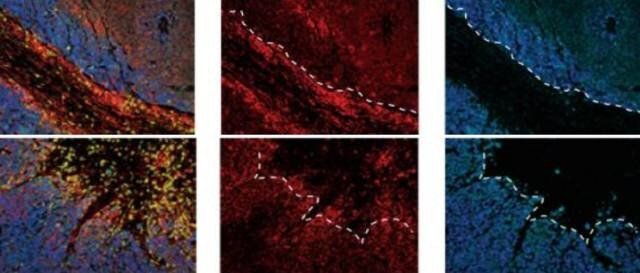
▲實驗步驟
→細胞或組織樣本準備:根據實驗需要,選擇適當的細胞或組織樣本,并進行適當的處理和固定。
→封閉非特異性結合位點:使用封閉液(如BSA)封閉樣本中的非特異性結合位點,以減少非特異性熒光信號的干擾。
→特異性抗體孵育:將特異性抗體加入樣本中,與抗原結合。根據抗體的類型和實驗要求,調整孵育時間和溫度。
→清洗:用PBS等緩沖液清洗樣本,去除未結合的抗體和雜質。
→熒光二抗孵育:加入熒光標記的二抗,與已結合在抗原上的特異性抗體結合,形成抗原-抗體-熒光復合物。
→再次清洗:再次清洗樣本,去除未結合的熒光二抗和雜質。
→熒光顯微鏡觀察:將樣本置于熒光顯微鏡下觀察,記錄和分析熒光信號的位置、數量和強度。
▲注意事項
①抗體選擇:選擇合適的特異性抗體是實驗成功的關鍵。在選擇抗體時,應考慮抗原的種類、來源、表達部位和表達水平等因素。
②抗體濃度:抗體濃度過高可能導致非特異性結合和背景信號的增加,而抗體濃度過低則可能導致信號強度不足。因此,在實驗中需要摸索合適的抗體濃度。
③封閉液的選擇:封閉液的選擇對于減少非特異性熒光信號的干擾至關重要。常用的封閉液包括BSA、血清等。
④孵育時間和溫度:孵育時間和溫度會影響抗體與抗原的結合效率。一般來說,較長的孵育時間和較高的溫度有利于增加結合效率,但也可能導致非特異性結合的增加。因此,在實驗中需要摸索合適的孵育時間和溫度。
⑤清洗步驟:清洗步驟對于去除未結合的抗體和雜質至關重要。在實驗中需要確保充分清洗樣本,以避免非特異性熒光信號的干擾。
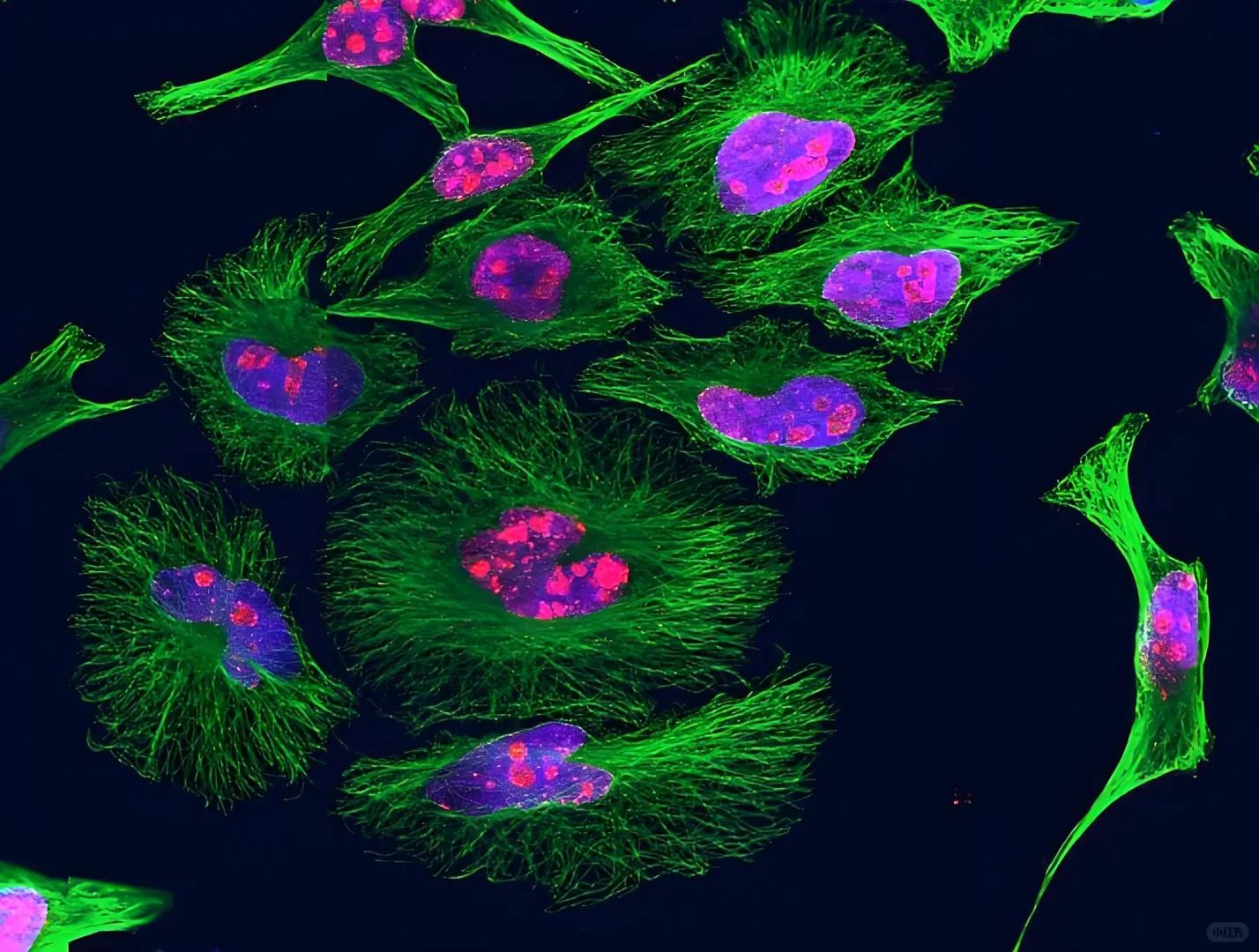
▲總結
免疫熒光染色實驗是一種強大的生物學和醫學研究工具,可以用于檢測細胞和組織中特定抗原的定位和定量。通過選擇合適的抗體、優化實驗條件、注意實驗細節和正確解讀實驗結果,可以獲得準確、可靠的數據,為科研和臨床診斷提供有力支持。
冰凍三尺,非一日之寒,普拉特澤致力于幫助廣大科研工作者解決免疫熒光染色實驗中的各方面問題,不但授人以魚,亦授人以漁。

