

PCR檢測支原體操作步驟【支原體檢測外包】
 2022-11-03 17:25:02
2022-11-03 17:25:02
來源/作者:普拉特澤-生物醫學整體課題外包平臺
PCR檢測支原體操作步驟由普拉特澤生物為大家總結分享,PCR檢測是支原體檢測中最常用的實驗方法,其他分別是化學發光法、DNA染色法、支原體培養法等。普拉特澤生物表達檢測平臺長期為廣大基礎科研人員提供支原體檢測外包服務,歡迎咨詢。
支原體因為個頭小,能穿過0.22 μm濾器,并且在實驗室內會潛在的擴散。支原體污染細胞后,培養液不一定會發生混濁。多數情況下細胞病理變化輕微或不顯著,細微變化也可由于傳代、換液而緩解,因此易被忽視。但個別嚴重者,可致細胞增殖緩慢,甚至從培養器皿脫落。所以支原體感染會使培養的細胞慢慢枯萎,使得用被污染的細胞樣本做的實驗完全失去
意義和價值。因此,有必要對新引進的細胞和實驗過程中的細胞株進行支原體檢測。
PCR法檢測的實驗原理是:原核生物的rRNA堿基序列非常保守,而rRNA操縱子上編碼rRNA的DNA間隔區如16S和23S間隔區,各種生物種間的堿基序列差別很大。這個間隔區的DNA 序列及長度在Mycoplasma 各個種間既有相對保守的部分,也有具有很大差異的部分。本制品是在編碼16S 和23S rRNA的DNA 上設計一對F1/R1 引物,擴增編碼16 S 和23S rRNA 的DNA 間隔區。此反應體系只特異性擴增 Mycoplasma DNA,檢出靈敏度與特異性都很高。
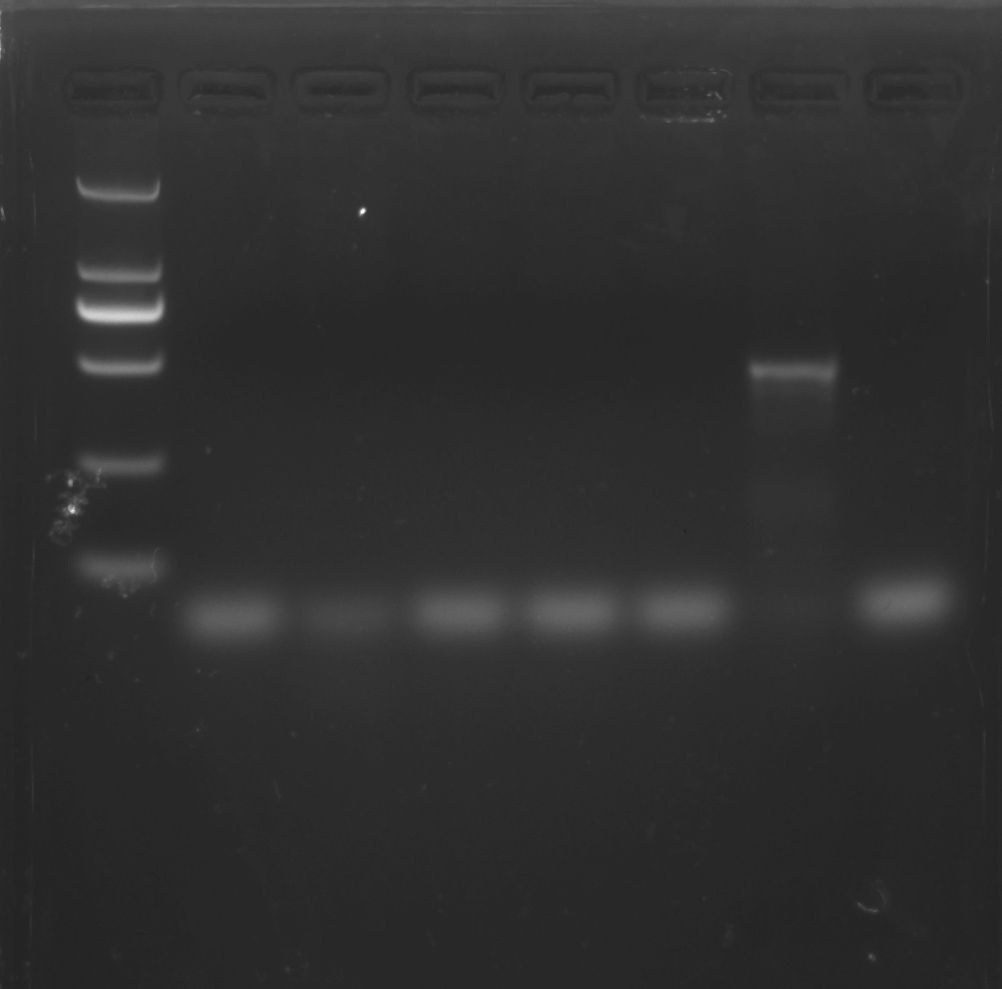
PCR法檢測支原體操作步驟
如下:
1、支原體樣品預處理
收集200 ul樣品于PCR管中,12000rpm離心5分鐘,去除上清液,加入30 ul純水或者PBS重懸,然后將其置于95℃加熱10分鐘,冷卻到12℃,最后8000rpm離心2分鐘,上清液為樣品備用。
2、支原引物檢測
3、PCR檢測
(1)將合成的引物稀釋成終濃度為100 nmol/L的儲藏液與10 nmol/L的工作液。
(2)配制PCR預混液。
(3)向以上反應混合液中加入檢測樣品(5ul以下),使總體積達到50ul。添加樣本時應防止交叉污染。
(4)把反應管放入PCR儀中,設定以下條件,進行PCR反應。PCR的檢測下限是M. capricolum 1ng, M. hyopneumoniae和U. urealyticum 100pg、其他的Mycoplasma是10pg。但是Human DNA、Mouse DNA在100 ng時有非特異性片段擴增。
(5)預先配置好1~1.5%的瓊脂糖膠,將完成的PCR反應液依次加入到膠孔中并選擇合適的Marker進行瓊脂糖凝膠電泳。
4、實驗注意事項
(1) PCR反應的前期操作應在無菌環境中進行。
(2)檢測前,待測細胞要用無雙抗培養基培養7d。
PCR法檢測支原體因為操作簡單、準確率高成為大家檢測支原體最常用的方法,那PCR檢測支原體的步驟和注意事項就給大家介紹到這里啦,如果您還有什么其他的技術問題或支原體檢測外包的需求歡迎直接留言給客服,技術會第一時間回復您的哦~

