

RACE實驗提高擴增特異性和效率的新方法
 2024-12-19 15:54:29
2024-12-19 15:54:29
來源/作者:普拉特澤-生物醫學整體課題外包平臺
在RACE實驗中,提高擴增特異性和效率是實驗成功的關鍵。普拉特澤生物承接RACE實驗等相關服務上萬例,積累了操作大量經驗,為大家詳細分享RACE實驗提高擴增特異性和效率的新方法,同時為廣大科研工作者開展線上的理論培訓與線下實操
可承接綜合實驗外包服務。
在RACE實驗中,提高擴增特異性和效率是實驗成功的關鍵。以下是一些新方法,可以幫助你在進行RACE實驗時提高擴增的特異性和效率:
一、優化引物設計
?▲選擇合適的引物長度和GC含量?:
引物長度建議為23~28個核苷酸,GC含量為50%~70%。
較高的GC比例和Tm值(≥65℃,若>70℃使用Touchdown PCR)有助于提高產物的特異性。
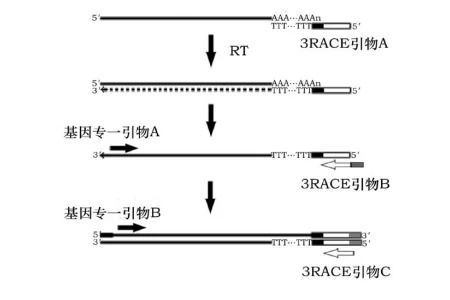
?▲設計多條基因特異性引物(GSP)?:
針對同一待測轉錄本可設計多條GSP,以提高擴增成功率。
若擴增效果仍然欠佳,則讓NGSP(巢式引物)的5'末端與GSP的3'末端有5~15個核苷酸的重疊,有助于提高二輪巢式擴增時的特異性。
▲避免引物自互補和錯配?:
避免使用自身互補性的引物序列,否則會產生回折和形成分子內氫鍵。
如果引物的3'末端有大約10個堿基和某個已知基因100%匹配,應堅決棄之不用,以避免后續的PCR反應中將此基因擴增出來。
二、改進反轉錄和PCR條件
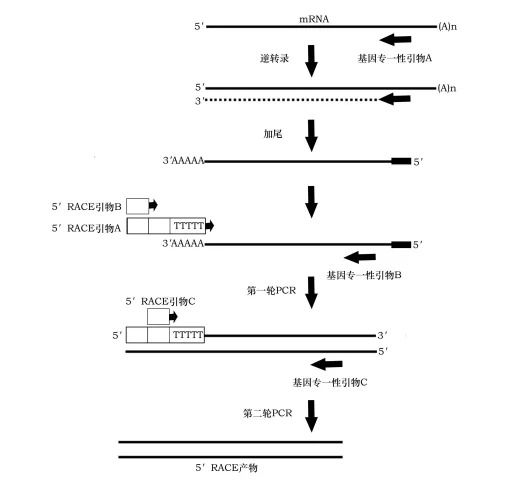
?●選擇合適的反轉錄酶?:
3'端的cDNA可使用MMLV酶,而5'端的cDNA則需要更高要求的SMARTScribe酶。
使用具有模板置換活性的逆轉錄酶和高保真快速擴增,可提高反轉錄和PCR的效率。
?●優化PCR擴增條件?:
采用熱啟動PCR和Touchdown PCR技術,可提高PCR反應的特異性。
Touchdown PCR是在最開始的循環中,退火溫度高于引物的Tm值,以增加對特異性條帶的擴增;隨后的退火和延伸的溫度降回到引物的Tm值,進行隨后的PCR循環。
若擴增目的片段>3kb,72℃延伸時長延長至1min;對于較長(>10kb)或豐度較低的轉錄本,GSP盡量靠近cDNA末端。
●減少非特異性擴增?:
使用低濃度的外側引物,并減少第一輪PCR反應的循環數。
然后取第一輪反應產物的1/10~1/20用于一對內側引物的巢式PCR,進行35~40個循環。
三、提高RNA質量和完整性
?▲使用高質量的RNA提取方法?:
盡量保證RNA的純度,如使用柱式RNA提取試劑盒。
在反轉錄前檢測RNA的完整度,可通過紫外分光光度原理的方法(如NanoDrop)檢查A260/A280值(代表蛋白殘留的程度,一般在2.0左右)和A260/A230的值(表示鹽離子、酚、醇等的殘留程度,一般在2.0~2.2);
或通過瓊脂糖凝膠電泳檢查RNA的完整性(條帶是否清晰,是否有完整的2~3條RNA條帶)。
?▲避免RNA降解和污染?:
【1】RNA提取物中無目的轉錄本或者目的轉錄本表達豐度低時,可以設計已知轉錄本區域的qPCR或PCR引物進行目的產物檢測;檢測后發現表達豐度低,可以增加RNA模板投入量。
【2】RNA質量直接影響到反轉錄的效率和cDNA的質量。如果RNA有降解或者含有DNA或蛋白質污染,可能導致反轉錄效率降低,或者合成的cDNA質量差,這些都會影響到后續的PCR擴增。
▲其他注意事項
?【1】RNA質量?:RNA的質量直接影響到反轉錄的效率和cDNA的質量。因此,在進行RACE之前,需要使用高質量的RNA提取方法,盡量保證RNA的純度。同時,操作前必須檢測RNA的完整度。
【2】試劑盒選擇?:選擇高質量的RACE擴增試劑盒,如全式金推出的TransScript? 5'/3' RACE Kit,該試劑盒包含熱穩定性高、合成速度快且具有模板置換活性的逆轉錄酶和高保真快速擴增,可以提高擴增的特異性和效率。
綜上所述,通過優化引物設計、選擇合適的反轉錄酶與PCR條件、應用巢式PCR技術以及注意RNA質量和試劑盒選擇等方面的方法,可以提高RACE實驗的擴增特異性和效率。
還有更多疑問建議或需要實驗外包的同學可點擊“普拉特澤”了解咨詢哦,提供原始數據,死磕真實實驗!還有實驗交流群可以互相探討哦!

