

同樣是蛋白電泳,SDS-PAGE和PAGE到底有啥不一樣?
 2025-08-07 17:27:48
2025-08-07 17:27:48
來源/作者:普拉特澤-生物醫學整體課題外包平臺
Question:同樣是蛋白電泳,SDS-PAGE和PAGE到底有啥不一樣?(普拉特澤生物提供長期穩定的分子實驗外包服務)
答:SDS-PAGE 毫無疑問是 PAGE 的升級版,二者都是常用的電泳分離技術,尤其是 SDS-PAGE更為常用,幾乎是 WB 實驗的標配;而 PAGE(或強調為NativePAGE)相比之下在蛋白質實驗中較少用到。
在這篇文章中,我們將討論幾個問題:
SDS-PAGE與原版PAGE在原理與應用范圍上有什么區別?
為什么WesternBlot實驗需要用SDS-PAGE?
Native PAGE適用于什么情形?
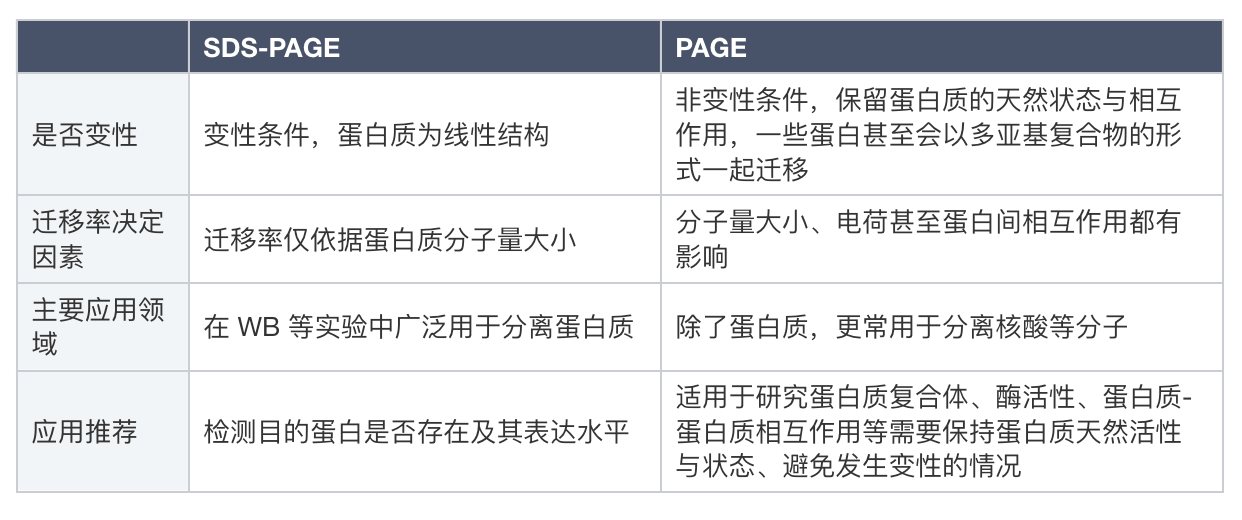
簡單來說,首先發明出的PAGE是基礎版,這個基礎版的原理就是分子篩+電場。作為一個分離工具,用它跑什么分子都可以。但由于分離蛋白的需求,加上蛋白質分子的特性,為了在蛋白實驗中加強蛋白質的分離效果,于是就有人想到在樣本與緩沖液中額外加入SDS使蛋白質變性,使蛋白質分子在電泳過程中僅依據分子量大小進行分離,這就是SDS-PAGE。
它們的核心區別毫無疑問在于是否加入SDS(十二烷基硫酸鈉),這是一種離子型去垢劑,通過破壞蛋白質中的非共價鍵使之變性,從三維構象變成線性結構,這個過程通常被稱為蛋白質線性化。另一方面,SDS與蛋白質結合后形成復合物,通過賦予蛋白質大量負電荷來掩蓋蛋白質本身表面攜帶的電荷,使其在電泳時的遷移率僅由分子量大小決定,而不受其原始電荷或形狀的影響。
WB一般都使用SDS-PAGE分離蛋白質,原因有以下幾點:
1. 抗體識別線性表位:由于許多抗體只能識別蛋白質的線性表位,需要通過SDS-PAGE將蛋白質線性化,使其抗體表位暴露在外,以便抗體結合。
2. 分子量測定:變性后的蛋白質在電場中的遷移率僅與分子量有關,可以用Marker測量,從而準確估計目標蛋白的分子量。
3. 穩定性:變性過程破壞了蛋白的活性,避免發生反應,蛋白理論上性質更穩定一些。
4. 避免蛋白質聚集:變性過程破壞非共價相互作用,避免蛋白質聚集或形成復合物。跑WB為了后期抗體結合出清晰的條帶,需要讓樣本中的蛋白質混合物分離成清晰的一個一個的分子;一旦發生聚集,條帶就不準確了。
原生版的PAGE是非變性的(NativePAGE),不加入SDS等變性劑,因此它最大的特點就是保留了蛋白質的活性。如果說SDS-PAGE是為了通過變性加強蛋白分離效果的魔改版,那么現在也有針對讓PAGE保留蛋白活性的魔改升級版,如BN-PAGE。
針對PAGE非變性這一特點,它更適合應用在以下領域:
1. 需保持蛋白質活性的情況:由于是非變性條件,蛋白質保持其高級結構,因此其生物活性也得到保留。如果此時電泳僅作分離,后續還要繼續研究如酶活性、配體結合能力以及其他需要保留原本功能的情況,就需要選擇非變性的PAGE進行分離。
2. 分析蛋白質聚集體或蛋白質-蛋白質相互作用:NativePAGE可以用于分析蛋白質復合物。由于保留了蛋白間的相互作用,因此某些蛋白質也可能會以多亞基復合物的形式一起遷移,并以不可預測的方式移動。這種復合物常表現為彌散狀條帶,而非通常所見的清晰的條帶。
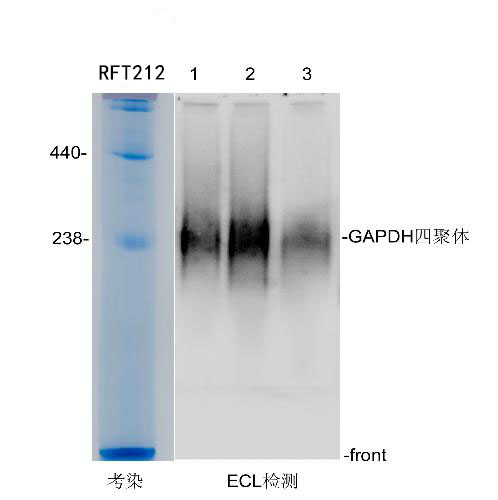
文源自實驗室老司機
今天關于SDS-PAGE和PAGE就分享到這兒啦~如果您在實驗過程中遇到技術問題,或者需要實驗外包和代做,可與我們技術老師聯系18570028002(微信同號)

