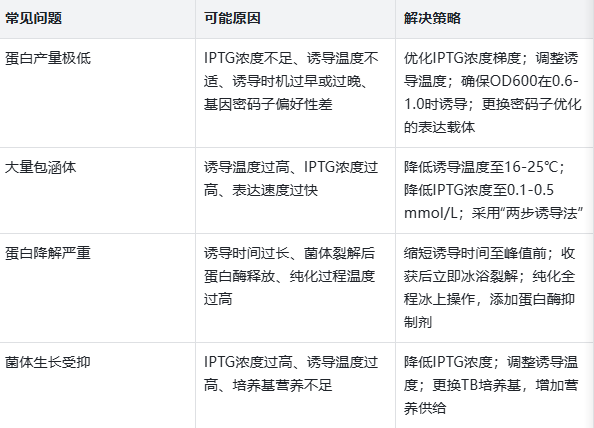
原核重組蛋白表達純化多少錢?幾千起高效交付
 2025-10-20 17:46:51
2025-10-20 17:46:51
來源/作者:普拉特澤-生物醫學整體課題外包平臺
基礎濃度范圍:常規外源蛋白的誘導,IPTG終濃度建議從0.1 mmol/L到1.0 mmol/L進行梯度測試,這是經過大量實驗驗證的“安全有效區間”。
低濃度優先測試:對于分子量較大、結構復雜(如含多個跨膜區)的蛋白,建議先從0.1-0.5 mmol/L的低濃度開始測試,降低包涵體形成概率;對于小分子、易折疊的蛋白,可適當提高濃度至0.5-1.0 mmol/L。
特殊情況調整:若使用T7強啟動子系統,由于啟動效率極高,低濃度IPTG(0.1-0.3 mmol/L)即可滿足需求,過高濃度反而易導致菌體裂解;若誘導后菌體生長緩慢,可直接降低濃度至0.2 mmol/L以下。
梯度溫度測試:建議設置37℃、30℃、25℃、16℃四個梯度,這是覆蓋“高效合成”與“高效折疊”的核心區間。例如:酶類蛋白多適合16-25℃誘導,而結構簡單的標簽蛋白可在37℃高效表達。
結合菌體密度調整:37℃誘導時,菌體生長快,可在OD600達到0.6-0.8時加入IPTG,誘導時間3-5小時即可;16℃低溫誘導時,菌體生長慢,建議OD600達到0.8-1.0時誘導,誘導時間延長至12-20小時(過夜誘導)。
包涵體的“挽救”策略:若37℃誘導出現大量包涵體,可嘗試“兩步誘導法”——先在37℃誘導1小時啟動表達,再降溫至16℃繼續誘導16小時,利用前期快速合成積累的蛋白,在低溫下完成折疊。
基礎時間梯度:根據溫度設置梯度,37℃時每1小時取樣一次(3-5小時內),16℃時每4小時取樣一次(12-20小時內),通過SDS-PAGE電泳檢測蛋白表達量,找到峰值時間。
啟動子適配原則:強啟動子(如T7)表達速度快,峰值出現早,37℃下3-4小時即可達到峰值;弱啟動子(如lac)表達速度慢,峰值出現晚,可能需要延長至5-6小時。
避免過度誘導:誘導時間超過峰值后,即使繼續培養,蛋白量也不會增加,反而可能因菌體裂解導致蛋白釋放到培養基中,增加純化難度,因此需嚴格把控收獲時間。
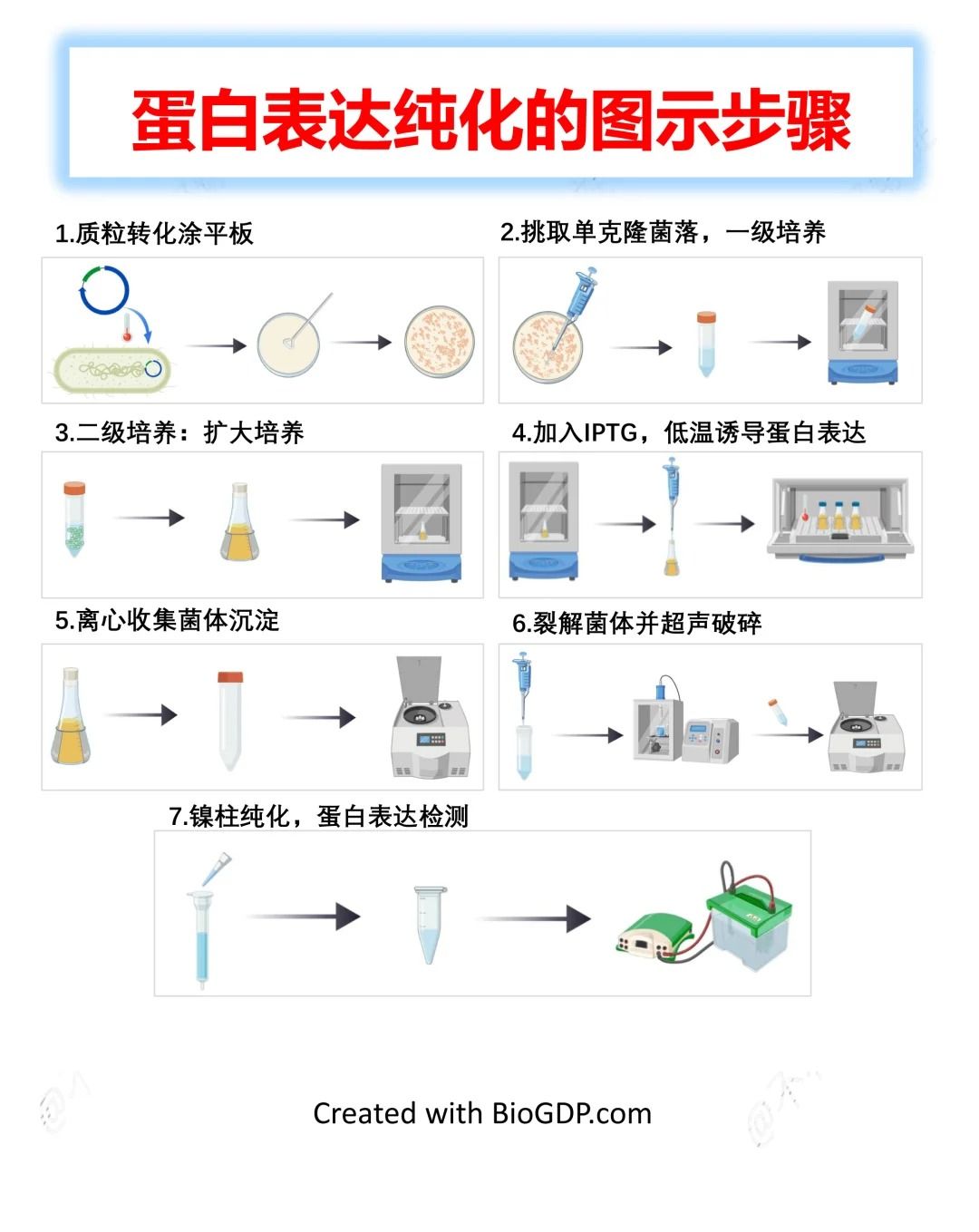
誘導時機:菌體對數生長期是“黃金窗口”:誘導必須在菌體處于對數生長期(OD600=0.6-1.0)時進行,此時菌體代謝旺盛,蛋白合成能力最強。若在OD600<0.6的延遲期誘導,菌體活力不足,表達量低;若在OD600>1.0的穩定期誘導,菌體代謝減緩,且可能積累代謝廢物,影響蛋白質量。
培養基成分:適配菌體生長與蛋白表達:LB培養基是常規選擇,但對于高需求蛋白,可使用TB培養基(含胰蛋白胨、酵母提取物、甘油),甘油能提供更持久的碳源,延長菌體對數生長期,提高表達量;若蛋白需要特定金屬離子輔助折疊(如金屬酶),可在培養基中添加適量Mg2+、Mn2+等。
pH值與滲透壓:維持菌體穩定:誘導過程中,菌體代謝會產生酸性物質,導致培養基pH下降,影響菌體活力。可在培養基中加入10-20 mmol/L的Tris-HCl(pH7.5)緩沖液穩定pH;對于鹽敏感菌株,需控制培養基滲透壓,避免菌體裂解。