細胞轉染是一種將外源核酸(如DNA或RNA)導入細胞的技術,廣泛應用于生物醫學研究和藥物開發。在生物醫學研究中,細胞轉染是一項核心技術,它使得我們能夠將外源基因引入細胞內,研究基因功能和信號通路。
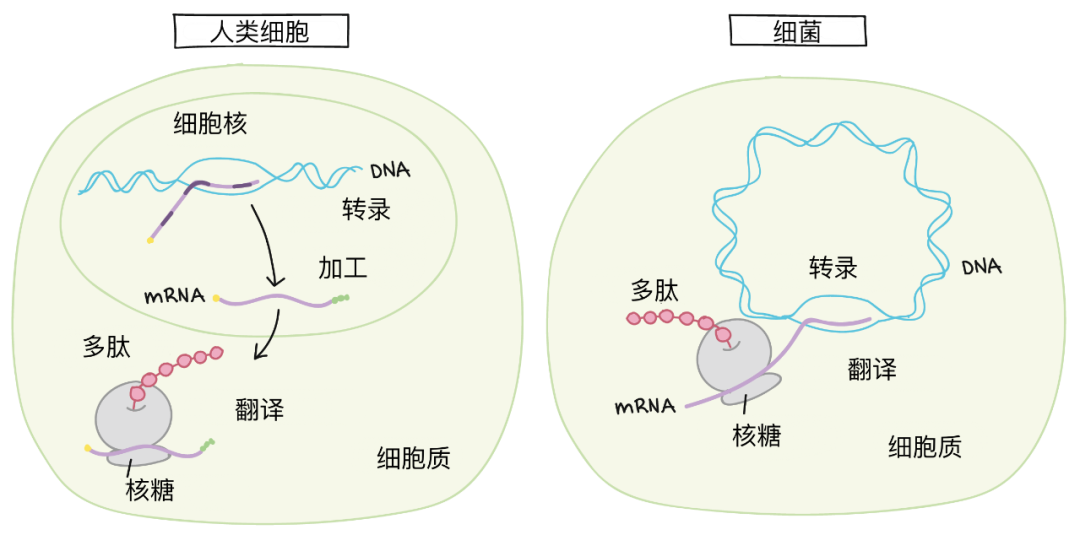
一.細胞轉染分類
1根據轉染方式分類可以分為:
化學轉染:主要有脂質體介導的轉染(Lipofection)、陽離子聚合物轉染(如聚乙烯亞胺PEI)、磷酸鈣共沉淀法等。物理轉染:主要包括電穿孔(Electroporation)、顯微注射(Microinjection)、基因槍(Gene Gun)、超聲轉染(Sonoporation)等。生物轉染:主要是病毒介導的轉染,使用改造后的病毒(如腺病毒、慢病毒、腺相關病毒AAV)將外源基因導入細胞,適用于長期和穩定的基因表達。核糖核酸(RNA)轉染:包括mRNA轉染、siRNA/miRNA轉染等。此外,還有基因編輯技術比如CRISPR/Cas9系統:利用CRISPR/Cas9技術進行精確的基因編輯,可以實現基因的敲除、插入或替換。其他轉染方法細胞穿透肽(Cell-Penetrating Peptides, CPPs)、磁珠介導的轉染。
選擇合適的轉染方法時,需要考慮細胞類型、實驗目的、核酸的性質、實驗條件以及對細胞毒性的要求。不同的轉染方法有其特定的優勢和局限性,因此在實際操作中可能需要根據實驗需求進行優化和調整。2.根據轉染是否把外源核酸整合到宿主染色體分為:
瞬時轉染:將外源性核酸引入細胞,使其在短時間內表達目標基因,不整合在細胞的染色體上。核酸在細胞內僅存在較短時間,適合于需要快速獲取數據的實驗,能夠迅速檢測基因功能或表達。穩定轉染:將外源性核酸引入細胞,使其整合到細胞染色體中,實現長期表達。通過篩選和擴增,雖然建立過程較長,但提供了穩定的表達系統,適用于生產和長期研究。
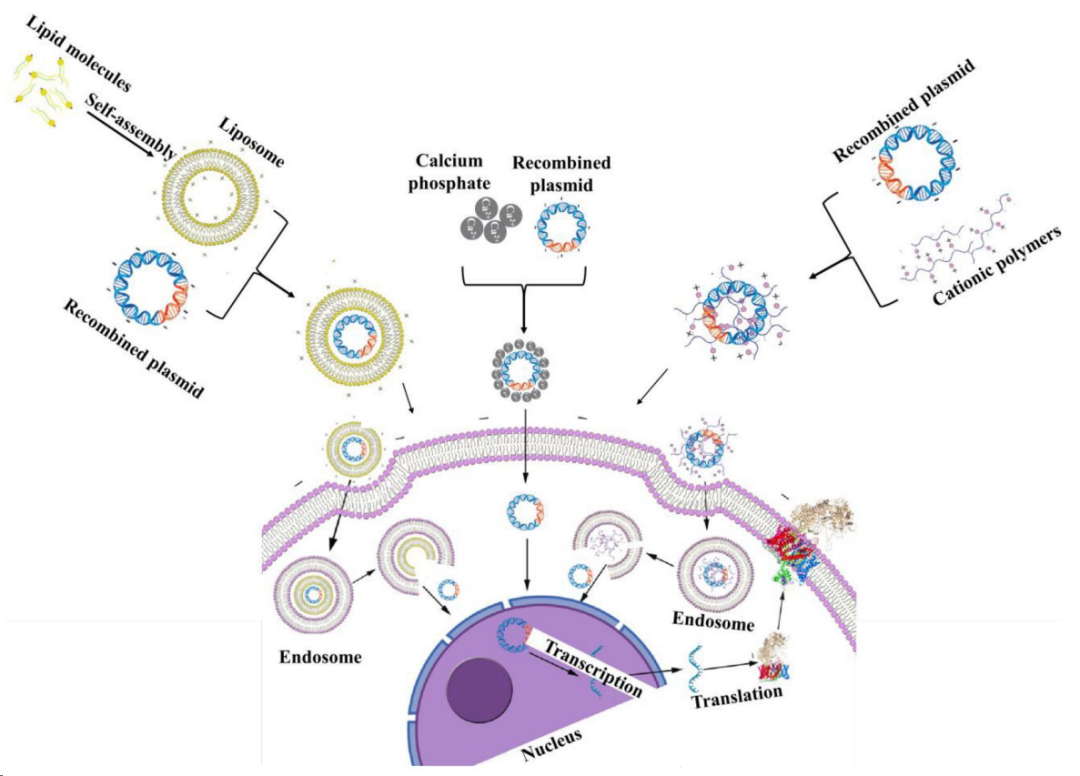
二.細胞轉染實驗常見的問題及解決方案
1.轉染效率低
可能是由于細胞狀態差或細胞密度不適宜。應選擇生長狀態良好的細胞,并按照轉染試劑要求的密度接種細胞。
轉染條件需要優化,比如調整陽離子脂質體試劑和DNA的量。 如果在存在血清的條件下形成DNA-陽離子脂質體試劑復合物,可能會降低轉染效率。建議在復合物形成時不要使用血清。 檢查轉染體系中是否存在抑制劑,如抗生素、EDTA、檸檬酸鹽等,這些可能會影響轉染效率。
2.細胞死亡率高:
DNA量太高或陽離子脂質體試劑量太高都可能導致細胞死亡率增加。建議進行劑量-反應曲線實驗以確定最佳用量。 避免在轉染過程中使用抗生素,因為陽離子脂質體試劑可能使細胞對抗生素更敏感。
2.轉染重復性不好:
保持所有轉染參數恒定,如融合度、傳代次數和生長時間,以減少批次間的波動。
如果細胞在培養過程中發生變化,可能影響轉染的重復性。建議使用來源于經選擇轉染效率較高的亞系細胞,或使用新融化的細胞進行實驗。
3.電轉后細胞死亡率高:
優化電轉參數,如電壓、脈沖時間和脈沖次數,針對目標細胞確定最佳的電轉參數。
使用合適的電轉緩沖液,確保能夠有效導電,同時減少細胞損傷。 確保加藥時間適宜,一般建議轉染后48小時再加藥,以確保細胞有足夠的時間表達抗性基因。調整加藥濃度,確保不超過抗性基因能夠應對的范圍。
5.配制轉染復合物時是否一定要用無血清培養基:
通常建議使用無血清的培養基或轉染試劑自帶的組分,因為血清中的蛋白質可能干擾陽離子脂質體/聚合物對核酸的吸附。
6.轉染效率的驗證:
使用qPCR進行驗證是最準確的。也可以通過熒光觀察,尤其是使用病毒轉染時,可以添加熒光標記幫助觀察轉染效率。
通過以上措施,可以提高細胞轉染的效率和成功率,減少實驗中的變量和潛在問題。


 2025-01-16 11:51:39
2025-01-16 11:51:39


