

蛋白質翻譯后修飾
 2024-11-12 09:33:13
2024-11-12 09:33:13
來源/作者:普拉特澤-生物醫學整體課題外包平臺
人類約有2.5W個基因、小鼠約有3W個基因、水稻約有5-6W個基因、擬南芥約有2.5W個基因、果蠅約有1-1.5W個基因、酵母約有6500個基因。
問題來了?有這么多基因,就會有這么多蛋白質嗎?
如果按一個基因對應一個蛋白質來算,人類的2.5萬個基因能翻譯合成2.5萬種蛋白質,解析人類全部蛋白質似乎指日可待。但,事與愿違,這2.5萬種基因編碼的蛋白質個個都是“千變萬化”的孫悟空,而且每個孫悟空,都具有超過400種不同的變化形態,不同的變化形態還可能同時進行。因此,解析全部的蛋白質結構和功能,就變得非常非常的困難,這令科學家們點燈熬油、抓耳撓腮、還百思不得其解。。。
為什么會產生這種現象呢?聽過我們之前,關于轉錄本那期的小伙伴可能知道,單個基因在轉錄后,可以通過可變剪接、或RNA編輯等,產生多個不同的轉錄本,不同的轉錄本可以形成不同的蛋白質亞型,這,是蛋白質多樣性的第一個原因。
而導致蛋白質千變萬化的第二個原因,則是蛋白質翻譯后修飾的存在。
顧名思義,蛋白質的翻譯后修飾就是指,在已經翻譯出來的蛋白質上,添加上各種千奇百怪的功能基團的過程。據報道,人體內發生的蛋白質翻譯后修飾種類,超過了400種,常見的,有磷酸化修飾、甲基化修飾、乙酰化修飾、泛素化修飾、糖基化修飾、蘇木化修飾、乳酸化修飾等等。。。。這些可以單獨、或多個,同時發生于某個特定時空里的蛋白質上,也可以發生在蛋白質生命周期的任何階段。簡單來說,我們,可以把剛剛翻譯出來的蛋白質看成是一個剛出生的小baby,把各種修飾看成是baby的衣服或裝飾品,在他今后的各個人生階段,他都可能會穿上不同的衣服,佩戴不同的裝飾品,直到生命的終點。搞不好,他還可能是一位穿搭博主或Coser,令認識他的人每次碰到他都很難認得出來。除了修飾的多樣性外,蛋白質的翻譯后修飾也是可逆的,就像這個baby穿上了某件衣服后,也可以脫下這件衣服一樣。
如果說,轉錄水平和mRNA 水平的變化增加了轉錄組相對于基因組的大小,那么無數種不同的蛋白質翻譯后修飾類型,則使得蛋白質組的大小相較于基因組和轉錄組呈現指數型的增加。目前,人體內的蛋白質總數已超過一億種。科學家們的目光也從基因組水平過渡到了更加復雜多變的蛋白質組,這,是一個必然的研究趨勢。

圖一、多種蛋白質形成的原因
我們來看看,如果DNA、RNA、蛋白質這三種生物大分子是一對一的關系,那么
2.5萬個基因,2.5萬個轉錄本,2.5萬種蛋白質,Over。
但現實是,2.5萬個基因,10萬種轉錄本,一億多種蛋白質。
二、蛋白質翻譯后修飾有哪些類型?
本期視頻我們將帶大家了解研究最為廣泛的第三類蛋白質翻譯后修飾,也就是氨基酸殘基的共價修飾。其余兩類修飾:一級結構修飾,以及輔基及金屬離子的結合修飾,受制于篇幅原因,本期視頻不做特別講解。
那什么是蛋白質氨基酸殘基的共價修飾呢?兩個重點,一,是發生在蛋白質氨基酸殘基的側鏈上,而非蛋白質主鏈上。二,是共價修飾。共價修飾是指蛋白肽鏈上的一些基團與化學基團或小蛋白質發生可逆的共價結合,從而改變蛋白的性質和功能。常見的共價修飾方式包括磷酸化、泛素化、甲基化、乙酰化、糖基化、乳酸化等等,由專門的酶類催化。接下來我們就將目前常見的幾類修飾類型一一進行講解。
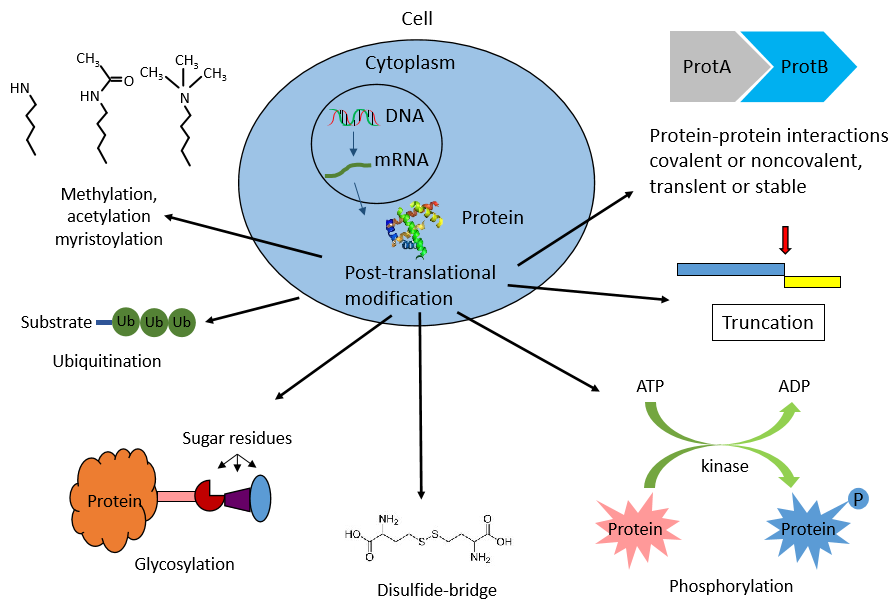
圖二、蛋白質翻譯后修飾類型
1. 磷酸化:
首先,我們來看一下蛋白質的磷酸化。在學習磷酸化這一修飾過程之前,我們先來了解一些背景知識:有研究發現,大多數控制我們身體中重要生理功能過程的蛋白質,如肌肉收縮或神經傳導,以兩種狀態存在:靜息與活躍。在細胞的靜息狀態下,它們是不活動的,而需要發揮作用時,這些蛋白質會通過添加或移除磷酸基團改變構象,從靜息形式轉換為活性形式,從而發揮生理功能,這一過程就涉及到蛋白質的磷酸化或去磷酸化。
蛋白質磷酸化是指由蛋白質激酶催化的,將ATP(三磷酸腺苷)或GTP(三磷酸鳥苷)上的磷酸基團轉移到底物蛋白質氨基酸殘基(主要是絲氨酸、蘇氨酸、酪氨酸)上的過程。該過程的逆過程則稱為去磷酸化。添加磷酸基團的酶叫做蛋白激酶,移除磷酸基團的酶叫做蛋白磷酸酶。初高中時期我們學習的ATP和ADP的相互轉化,應該是我們生物學習中最早接觸的磷酸化和去磷酸化,也是目前最主要的信號轉導方式。
接下來我們一起來看一下磷酸基團是如何加到目標蛋白上去的。
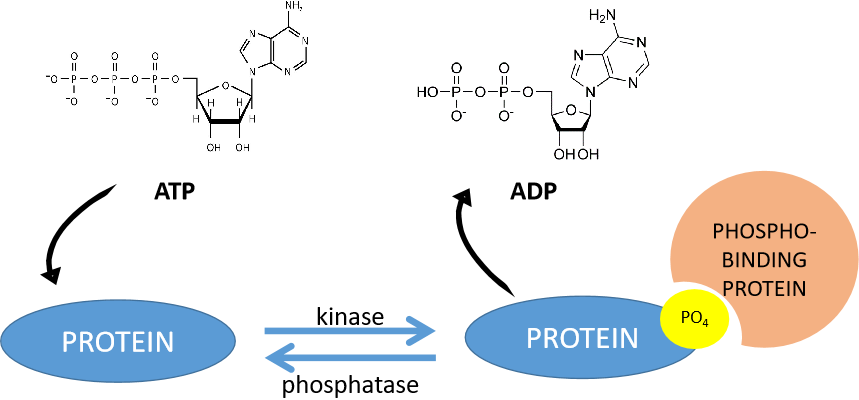
圖三、磷酸化作用機制
磷酸化到底有多重要呢?在研究信號通路的活化過程中,為什么大家都選擇檢測磷酸化修飾的蛋白質?因為蛋白質磷酸化修飾幾乎包含在所有的細胞反應中,也幾乎涉及所有類型的細胞信號轉導途徑。這種修飾方式能夠迅速且可逆地調節蛋白質的活性、穩定性和相互作用,是細胞對外界刺激作出反應的重要機制。
那么發生磷酸化后的蛋白質會發生什么變化呢?
① 首先,發生磷酸化后,蛋白質的表面電荷或構象會發生改變。這種變化可能使得某些酶類蛋白質的活性位點更加暴露或易于與底物結合,從而增強酶的催化能力,也可能影響到其與其他蛋白質或DNA、RNA等核酸的結合能力。
② 其次,磷酸化修飾可以影響蛋白質在細胞內的定位。例如,某些蛋白在磷酸化后可以暴露或隱藏自己的核定位信號,從而影響其在細胞核和細胞質之間的穿梭。
1. 泛素化:
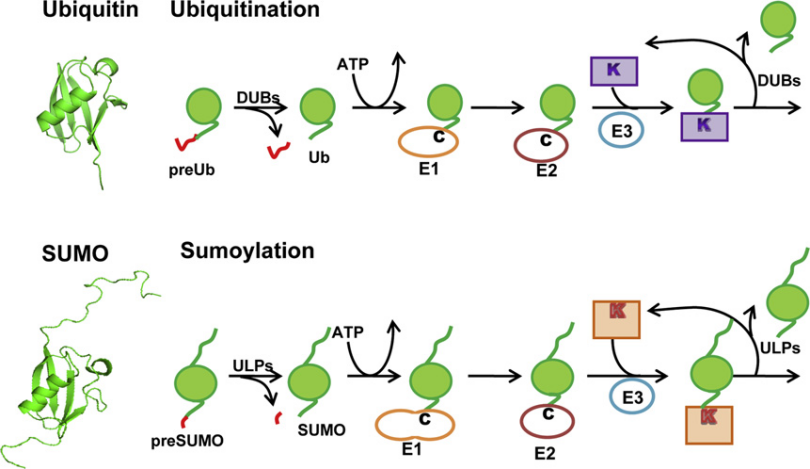
今天我們要學習的第二個蛋白質翻譯后修飾的類型是泛素化,在這之前也需要了解一些背景知識。首先問大家一個問題,什么是泛素?泛素是含76個氨基酸、大小約為8.6 kDa的小蛋白質。人類基因組中有四個基因編碼泛素:UBB,UBC,UBA52和RPS27A,泛素蛋白的氨基酸序列為:MQIFVKTLTGKTITLEVEPSDTIENVKAKIQDKEGIPPDQQRLIFAGKQLEDGRTLSDYNIQKESTLHLVLRLRGG。泛素具有7個賴氨酸殘基(K6,K11,K27,K29,K33,K48,K63)和一個甲硫氨酸殘基(M1)。泛素之間主要通過賴氨酸殘基和甲硫氨酸殘基進行連接,由此產生的泛素鏈具有一定的拓撲結構,可通過對蛋白底物進行修飾并決定底物的功能。
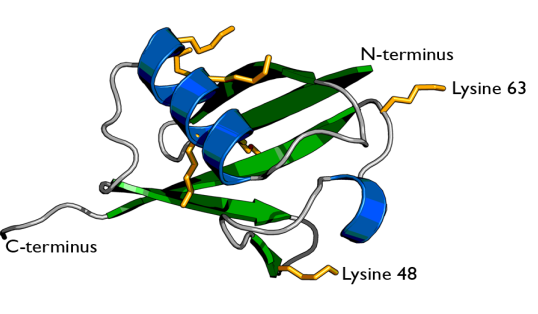
圖四、泛素分子的結構
將泛素添加到底物蛋白質中的過程稱為蛋白質的泛素化(具體表現為泛素的甘氨酸的C末端附加在目標蛋白的賴氨酸上),這種現象在真核生物中普遍存在且高度保守。蛋白質泛素化是一種動態的翻譯后修飾,幾乎涉及真核生物生命活動的所有方面。
泛素化的過程主要涉及三種酶類,分別是泛素激活酶E1、泛素結合酶E2、泛素連接酶E3。人源的E1酶類有2種:UBA1和UBA6;人源的E2酶類有35種;人源E3酶類有數百種。其中E3泛素化連接酶決定靶蛋白的特異性識別。泛素化的過程具體可分為以下三個步驟:活化、結合、連接(動畫演示)
簡而言之,也就是在E1、E2、E3三類酶的依次催化下,泛素以特異性的方式連接到靶標蛋白上或泛素鏈上。泛素化的逆過程為去泛素化,該過程由去泛素化酶(DUB)執行,去泛素化酶可以通過水解泛素分子之間或泛素與底物蛋白之間的肽鍵或異肽鍵,來逆轉泛素化修飾。該酶從底物中除去泛素并將泛素再循環到胞質池中。
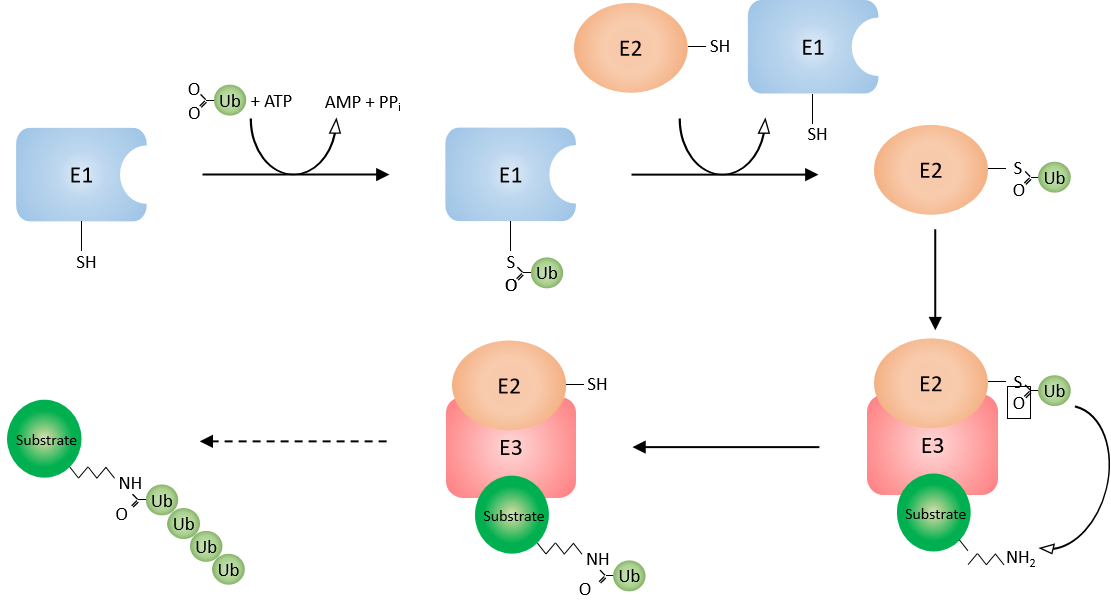
圖五、泛素化作用機制
被泛素化修飾后的蛋白質功能發生了哪些變化呢?
① 泛素化最為人熟知的作用是標記蛋白質進而蛋白質降解。泛素化過程中形成的泛素化鏈被26S蛋白酶體識別并介導蛋白質的降解,從而調節蛋白質的數量和細胞內的蛋白質狀態。此外,有些膜蛋白質或者酶被泛素化之后會進入溶酶體進而被降解。但是如果是單個泛素分子附著在靶蛋白上,這種修飾類型通常不會導致蛋白質的降解,而是通過改變蛋白質的空間構象進而影響蛋白質的活性。
② 泛素化可以修復DNA并調控轉錄。某些修復因子通過泛素化被招募到DNA損傷位點,從而參與DNA修復過程。此外,轉錄因子的泛素化可以影響其穩定性和轉錄活性,從而調控基因表達。
③ 泛素化可以影響蛋白質的定位。例如,它可以將蛋白質從細胞核轉移到細胞質,或者將膜蛋白送入內吞途徑。
④ 泛素化還調節受體蛋白的內吞和降解。泛素化修飾后的受體被內吞小體識別并包裹,形成內吞囊泡,進而與溶酶體融合,完成受體的降解。
⑤ 泛素化可以調控細胞自噬的過程。在自噬過程中,泛素化標記了需要被自噬體包圍并降解的損壞的細胞器或蛋白質聚集體。這是細胞清理內部大分子結構的一種機制。
1. 蘇木化:
蘇木(SUMO)是小泛素相關修飾物(small ubiquitin-related modifier)的縮寫,蘇木蛋白的大小約為10kDa,含有100個氨基酸殘基。蘇木蛋白與泛素的序列相似性僅18%,但二者在高級結構上高度相似,核心都是保守的Ub折疊(Ub-fold)結構域。蘇木蛋白與泛素蛋白有一個比較明顯的區別,那就是蘇木蛋白有一個長而靈活的N端延伸結構。
在人類基因組中,目前主要有4種亞型的SUMO蛋白,分別是SUMO1、SUMO2、SUMO3和SUMO4。這些亞型具有一定的序列差異,但總體上都保持了相似的結構和功能。在氨基酸水平上,SUMO2與SUMO3具有97%的同源性(通常簡稱為SUMO2/3),而其與SUMO1只有46%的同源性。目前SUMO1、SUMO2、SUMO3的功能已陸續被解析,SUMO4主要在腎臟、脾臟組織和淋巴結等免疫組織中表達,其功能尚不明確,但有研究發現SUMO4與1型糖尿病的易感性具有相關性。
圖六、蘇木蛋白與泛素蛋白的結構比較
蛋白質蘇木化(SUMOylation),是指小分子泛素相關修飾蛋白SUMO共價結合到目的蛋白質的賴氨酸殘基上,導致目的蛋白分子被修飾的過程。1996年,類泛素蛋白修飾分子SUMO及SUMO化修飾首次被研究報道,近20年來,從酵母到人等各種真核細胞都發現其修飾的底物蛋白,SUMO化修飾已經被視為一種很普遍的蛋白翻譯后修飾方式。SUMO化修飾同樣是一個可逆的過程。去蘇木化蛋白(如SENPs)可以去除與目標蛋白質結合的SUMO分子,從而恢復目標蛋白質的原始狀態。這種可逆性使得SUMO化修飾在細胞信號傳導和基因表達調控中具有重要的調節作用。
蛋白質蘇木化主要包括以下步驟:SUMO前體的成熟、活化、結合、連接等
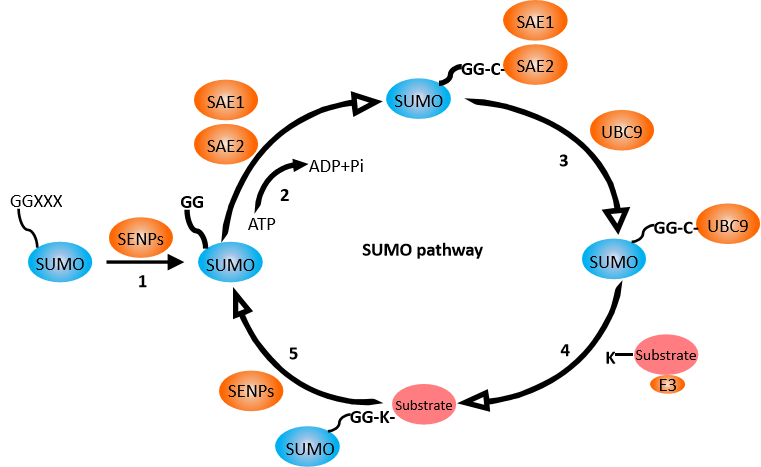
圖七、蘇木化作用機制
蛋白質經歷蘇木化修飾后其功能會發生哪些變化呢?
① 首先SUMO化可以保護蛋白質免受泛素化和蛋白質降解。例如,PML蛋白的SUMO化可以防止其被降解,從而增強其穩定性。
② 改變蛋白質的細胞內分布:SUMO化可以調控蛋白質在細胞核和細胞質之間的轉運。例如,某些轉錄因子在SUMO化后會轉運到細胞核內,從而調控基因表達。
③ 調控轉錄因子的活性:SUMO化可以抑制或激活轉錄因子的活性。例如,p53蛋白的SUMO化可以抑制其轉錄活性,從而調控細胞周期和凋亡。
④ 調節蛋白質-蛋白質相互作用:SUMO化可以改變蛋白質的構象或表面特性,從而影響其與其他蛋白質的結合。例如,SUMO化的RanGAP1在核孔復合體中的定位依賴于其與RanBP2的相互作用。
⑤ 參與DNA修復:SUMO化可以調節參與DNA修復的蛋白質的功能。例如,RAD51蛋白的SUMO化對同源重組修復過程至關重要。
⑥ 調控細胞周期(影響細胞周期的進程:SUMO化通過調控細胞周期相關蛋白的活性和穩定性,調節細胞周期的各個階段。例如,細胞周期蛋白CDK1的SUMO化在細胞分裂過程中起重要作用。
⑦ 調控凋亡:SUMO化可以調節凋亡相關蛋白的活性,從而影響細胞存活和凋亡。例如,Fas相關死亡域蛋白(FADD)的SUMO化可以抑制細胞凋亡。
2. 乙酰化
乙酰化是在乙酰基轉移酶的作用下,將乙酰的乙酰基COA連接到蛋白質賴氨酸殘基上上的過程。在去乙酰化酶的催化下使乙酰化蛋白脫去乙酰基的過程則為去乙酰化。蛋白質乙酰化主要分為兩類:蛋白N端的乙酰化修飾和蛋白賴氨酸上的乙酰化修飾。
① N端乙酰化修飾:主要由N乙酰轉移酶(NATs)催化,多發生在真核生物的新生蛋白上。
② 賴氨酸乙酰化修飾:是一個可逆的過程,主要由賴氨酸乙酰化酶(KATs)催化乙酰化,賴氨酸去乙酰化酶(KDACs)催化去乙酰化。
乙酰化修飾在真核和原核生物中都普遍存在,且對蛋白質構象、活性以及穩定性等調控具有重要的調控作用。最早的乙酰化研究主要集中在組蛋白上,隨著研究的深入,也有越來越多的非組蛋白乙酰化被發現。
賴氨酸乙酰化修飾主要包括以下步驟:(動畫演示)
① 在乙酰基轉移酶的催化下,乙酰輔酶A與蛋白質的賴氨酸殘基發生反應。
② 乙酰基轉移酶提供反應的微環境,使得攜帶乙酰基的乙酰輔酶A與接受乙酰基的受體蛋白(蛋白質賴氨酸殘基)高度貼近。
③ 轉乙酰基酶催化賴氨酸殘基的氨基去質子化,使其處于親核狀態,進而親和進攻乙酰輔酶A的羰基碳。
④ 最后,完成蛋白質的乙酰化并釋放輔酶A。
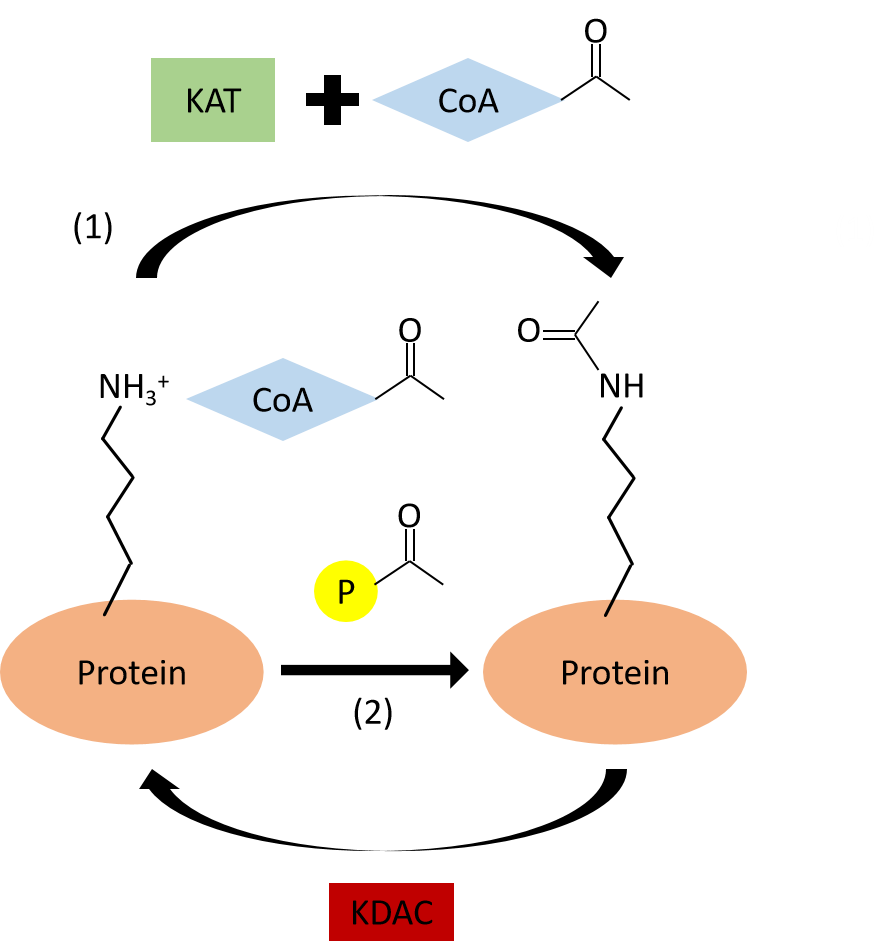
圖八、乙酰化作用機制
蛋白質經歷乙酰化修飾后其功能會發生哪些變化呢?
① 影響染色質結構和基因表達:組蛋白乙酰化是調控基因表達的重要機制之一。組蛋白上的賴氨酸殘基被乙酰化后,染色質結構變得更加松散,使得轉錄因子和RNA聚合酶更容易接觸DNA,從而促進基因表達。反之,去乙酰化會使染色質變得更加緊密,抑制基因表達。
② 調控蛋白質的穩定性:乙酰化修飾可以保護蛋白質免受泛素化和隨后的蛋白質降解。例如,p53蛋白的乙酰化可以增強其穩定性和功能,抑制其被泛素化和降解。
③ 調節蛋白質-蛋白質相互作用:乙酰化可以中和賴氨酸殘基的正電荷。這種電荷變化可以影響蛋白質與其他帶電分子或蛋白質的結合能力。例如,乙酰化的p300/CBP與轉錄因子結合,調節轉錄活性。
④ 調控轉錄因子的活性:乙酰化可以改變轉錄因子的構象,從而影響其DNA結合能力和轉錄活性。例如,乙酰化的p53具有更高的轉錄活性,可以有效啟動凋亡相關基因的表達。
⑤ 調控細胞周期進程及凋亡:乙酰化可以調節細胞周期蛋白及凋亡相關蛋白功能,影響細胞周期的各個階段及細胞的生存和凋亡。
⑥ 參與DNA修復:乙酰化的蛋白在DNA損傷部位的聚集,有助于DNA修復蛋白的招募和修復過程的進行。
⑦ 調節代謝酶的活性:乙酰化后的蛋白代謝酶的功能和活性改變。例如,乙酰化的丙酮酸脫氫酶(PDH)活性降低,影響葡萄糖代謝過程。
⑧ 應對細胞應激條件:乙酰化后的蛋白正通過調控應激反應相關蛋白的活性和穩定性,幫助細胞應對各種應激條件。例如,熱休克蛋白Hsp90的乙酰化在應激條件下調控其功能。
3. 糖基化
在學習糖基化之前我們先來了解一下糖和糖蛋白。糖蛋白是由糖類與蛋白質共價結合的分子,糖類的范圍從單糖到復雜具有側鏈結結構的多糖,種類眾多。而糖基化是一種將糖類分子通過共價鍵連接到蛋白質氨基酸殘基上的過程,這個過程通常在內質網和高爾基體中進行,涉及多種糖基轉移酶的參與。糖基化過程十分復雜,目前在很多蛋白中(如轉錄因子、熱休克蛋白、核小孔蛋白、RNA聚合酶II、致癌基因翻譯產物、酶等)都發現了糖基化這種翻譯后修飾方式。
蛋白質糖基化主要有兩種類型:O-糖基化和N-糖基化。O-糖基化發生在絲氨酸(Ser)和蘇氨酸(Thr)的羥基上,如果這些氨基酸首先被羥基化,也可以發生在賴氨酸(Lys)和脯氨酸(Pro)上。O-糖基化由于沒有明確的共識序列或共同核心結構,因此研究較為復雜。
而N-糖基化主要涉及糖鏈與新生肽鏈中特定天冬酰胺(Asn)自由的NH2的連接,也是目前主要研究的對象。N-糖基化有一段共識序列:Asn-Xaa-Ser/Thr,其中Xaa代表除脯氨酸(Pro)以外的任何氨基酸。這個序列是N-糖基化發生的基礎,即當蛋白質序列中存在這樣的天冬酰胺(Asn)殘基時,其側鏈的氨基就有可能被N-連接的糖鏈所修飾。N-糖基化
還有一個共同核心結構是一個由2個N-乙酰葡糖胺(GlcNAc)和3個甘露糖(Man)分子組成的五糖結構,通常表示為GlcNAc2Man3。這個核心結構是N-糖鏈的基礎,所有的N-糖鏈都是在這個核心結構上進一步延伸和修飾而成的。
糖基化包括五個步驟(以N-糖基化為例):寡糖鏈合成、轉移酶識別、糖鏈轉移、加工修飾。(動畫演示)
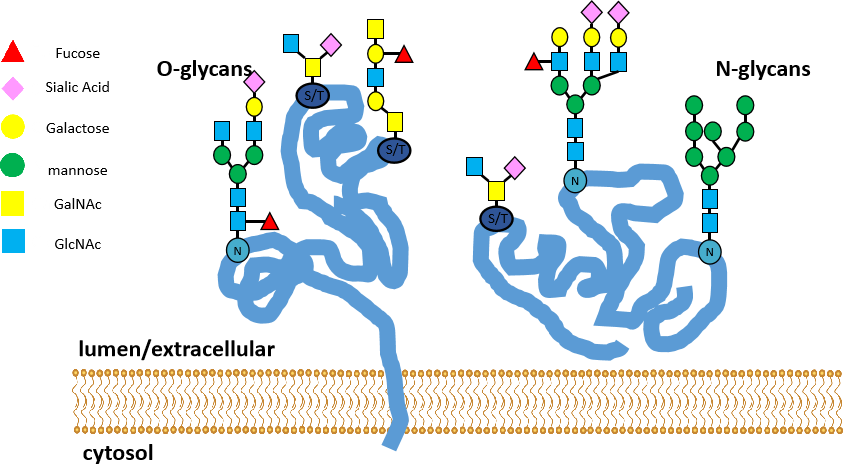
圖九、糖基化作用機制
作為一種普遍存在的翻譯后修飾,糖基化后的蛋白質功能有哪些改變呢?
① 免疫保護:糖基化可以影響免疫球蛋白(抗體)的結構和功能,進而影響其識別并結合抗原的能力。此外,細胞表面的糖基化蛋白還能作為“自我”與“非我”的識別標志,幫助免疫系統區分外來病原體和自身組織。
② 病毒的復制:病毒在感染細胞時,會利用宿主細胞的糖基化機制來修飾自己的蛋白質和糖蛋白,這些修飾對于病毒顆粒的組裝、成熟、釋放以及逃避宿主免疫系統的攻擊都至關重要。例如,流感病毒的血凝素(HA)蛋白上的糖基化修飾可以影響病毒的感染性和抗原性。
③ 細胞生長:細胞表面的糖基化模式與細胞的增殖、分化和凋亡等過程密切相關。特定的糖基化修飾可以調控生長因子受體的活性和信號轉導途徑,從而影響細胞的生長速率和命運。
④ 細胞與細胞之間的黏附:細胞表面的糖蛋白和糖脂通過其糖鏈部分與相鄰細胞或細胞外基質中的分子相互作用,介導細胞間的黏附和信號傳遞。這些相互作用對于組織結構的維持、細胞遷移、傷口愈合等過程至關重要。
⑤ 炎癥的產生:在炎癥反應中,糖基化修飾也發揮著重要作用。例如,某些炎癥介質(如細胞因子和趨化因子)的糖基化修飾可以影響其穩定性和生物活性,從而調控炎癥反應的強度和持續時間。
1. 乳酸化
乳酸 ( Lactate ) 是細胞糖酵解途徑重要的含碳代謝產物,它的生物學功能因腫瘤細胞中Warburg效應的存在,得到了廣泛關注(該理論認為,腫瘤細胞即使在有氧條件下,也傾向于通過糖酵解途徑(而非線粒體氧化磷酸化)來產生能量)。乳酸也是細胞無氧呼吸的代謝產物,早期被認為是細胞的代謝廢物,但隨著研究深入,乳酸被發現具有多種重要的生理病理功能。2019年10月24日,芝加哥大學趙英明教授課題組在Nature上發表研究成果,該研究揭示了乳酸在表觀遺傳學中的作用,并首次報道乳酸可以修飾組蛋白,從而調控基因的轉錄。該研究不僅拓展了大家對乳酸的認識,也掀起了乳酸化修飾的研究熱潮。由于乳酸化的研究起步較晚,目前對于蛋白質乳酸化的研究還在初步階段,大家也可以多多關注下這種修飾方式,其研究前景還是非常廣泛的。
由于目前乳酸化的修飾作用主要發現在組蛋白上,因此我們也對組蛋白做一個簡單的介紹。組蛋白是真核生物體細胞染色質與原核細胞中的堿性蛋白質,與DNA共同組成核小體結構。它們是染色質的主要蛋白質組分,作為DNA纏繞的線軸,在維持染色質結構和穩定性方面發揮關鍵作用,組蛋白的氨基酸序列在不同物種之間高度保守組蛋白,且能進行多種修飾。組蛋白修飾的調控可以被歸類為三類蛋白:Writers(寫入者)、Erasers(擦除者)和Readers(讀取者)。Writers是負責在組蛋白上添加修飾基團的蛋白,目前已被報道的組蛋白乳酸化Writers蛋白有p300、GCN5、HBO1。Erasers則是負責去除組蛋白上修飾基團的蛋白,恢復組蛋白的原始狀態,目前已報道組蛋白乳酸化的Erasers有:HDAC1-3、HDAC8和SIRT1-3。Readers是能夠識別和結合特定修飾基團的蛋白,從而調控基因表達和其他細胞過程,目前已被報道的組蛋白乳酸化Readers蛋白為Brg1蛋白。這三類蛋白共同參與組蛋白的動態修飾和功能調節。
蛋白質乳酸化的過程大概分為三步:乳酸與蛋白質的接觸、酶促反應、修飾產物的形成(動畫演示)
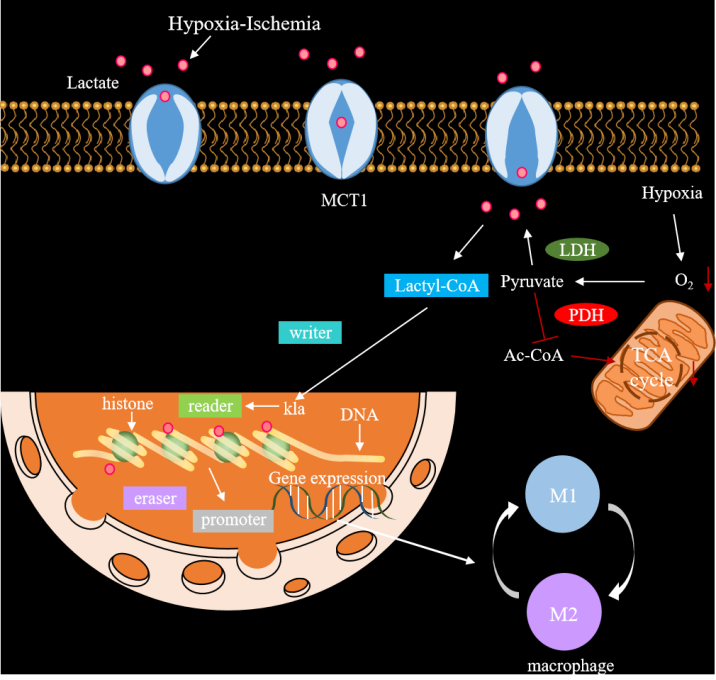
圖十、乳酸化作用機制
蛋白質發生乳酸化修飾之后功能會發生哪些變化呢?
① 影響轉錄因子功能:乳酸化可以修飾組蛋白,從而影響染色質結構和基因表達。例如,組蛋白H3的賴氨酸乳酸化被發現可以促進基因轉錄,特別是在高代謝活動的細胞中。
② 作為代謝與基因調控的橋梁:乳酸化作為代謝產物乳酸的一種修飾方式,可以連接細胞代謝狀態與基因調控,響應代謝變化調節基因表達,從而適應環境變化。
③ 調控炎癥基因:研究發現,乳酸化可以調節炎癥相關基因的表達,影響免疫細胞的功能。例如,在巨噬細胞中,乳酸化修飾可以激活炎癥基因,促進炎癥反應。
④ 影響癌癥細胞行為:乳酸化在癌癥中也具有重要作用。乳酸化修飾可能影響癌細胞的基因表達、代謝重編程和腫瘤微環境,從而促進腫瘤的生長和轉移。
⑤ 調控細胞分化和命運:乳酸化修飾可以影響細胞分化和命運決策。例如,乳酸化修飾可以調控干細胞和前體細胞的分化,影響組織發育和再生。
⑥ 信號傳導:乳酸化修飾可能影響關鍵信號分子的功能和相互作用,從而調控細胞信號傳導通路。盡管具體機制尚未完全闡明,但這一領域的研究正在不斷深入。
⑦ 響應代謝應激:乳酸化修飾可以作為細胞應答代謝應激的一種機制。例如,在低氧條件下,細胞通過增加乳酸化修飾來調節基因表達和代謝途徑,以適應缺氧環境。
⑧ 反饋調節代謝通路:乳酸化修飾可以作為代謝通路的反饋調節機制,通過修飾關鍵代謝酶和調控代謝基因的表達,維持細胞代謝的平衡和穩態。
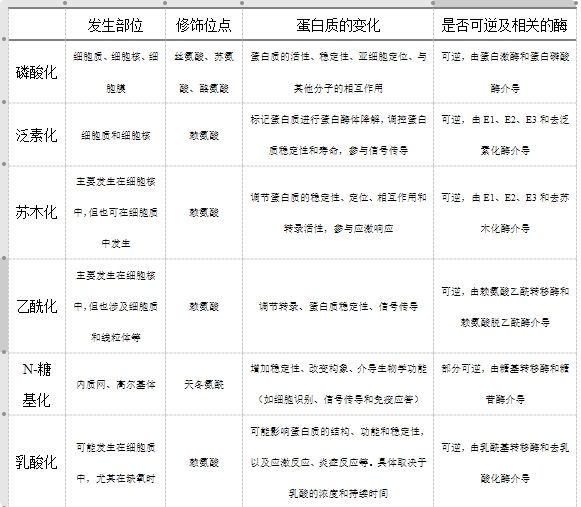
好了,上述我們給大家介紹了幾種常見的蛋白質修飾類型,現在咱們一起來總結一下。這里我們給大家繪制了一個表格(其中乳酸化作為一種新發現的蛋白質翻譯后修飾,其修飾的具體機制在現有研究中并不明確,因此我們根據相關研究進行了推測,僅供大家參考)。
表一、不同蛋白質翻譯后修飾的差異比較
三、蛋白質翻譯后修飾該如何來研究?
當前,大家對于蛋白質翻譯后修飾的探索和認識,很大程度上得益于質譜技術的發展。因為,傳統的檢測方法如Western或免疫沉淀等都依賴于特異性抗體,而抗體很難精確區分蛋白質上結合的小分子的差異,也很難對蛋白質上發生修飾的氨基酸位置進行精確定位。況且,除了模式動物以外,大部分物種表達的蛋白都缺乏有效的抗體,而翻譯后修飾分析的抗體更無從談起。此外,每一種蛋白的每一種修飾的每一個修飾位點,都需要對應的一種抗體來進行分析,其適用的范圍非常有限,分析成本太高,也難以應用于系統性層面上的研究。
相比而言,質譜不僅能夠對特定蛋白的特定修飾進行精確測定,還能夠實現大規模組學水平上的研究與發掘。因為發生翻譯后修飾的蛋白與未發生翻譯后修飾的蛋白,以及不同的修飾類型之間,最大的差異就在于氨基酸側鏈上化學基團的變化,這直接導致蛋白質或肽段在分子量上的差異,而分子量的分析是質譜的拿手好戲。因此在蛋白質翻譯后修飾方面,質譜已成為主流的研究技術。
根據蛋白質翻譯后修飾的定義我們可知,相較于沒有發生翻譯后修飾的蛋白,翻譯后修飾蛋白會在特定肽段序列有分子量的增加。同時,由于不同的翻譯后修飾對肽段質量的改變不同,通過比較實驗測得的肽段質量與理論質量之間的差異,我們可以判斷修飾的類型。下圖展示了利用質譜來鑒定蛋白質的翻譯后修飾的原理:在蛋白翻譯后修飾方式的質譜分析過程中,蛋白會首先被酶切成肽段,然后進入質譜進行分析;通過質譜分析,得到一系列肽段的相對分子質量信息,對于某一個特定的肽段而言,在沒有發生任何翻譯后修飾的情況下,它的序列信息和分子量是確定的。但當它發生了某種翻譯后修飾之后,例如磷酸化修飾,因為磷酸根的分子量也是確定的,所以在質譜檢測過程中,如果發現部分肽段的分子量剛好增加了一個磷酸根的分子量,則可以假設這個肽段發生了磷酸化修飾。再通過二級或多級質譜的圖譜進行二次確認,即可實現翻譯后修飾類型鑒定及修飾位點分析等。
圖十一、質譜技術檢測蛋白質翻譯后修飾原理示意圖
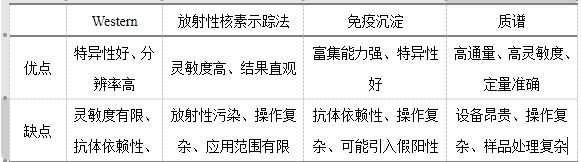
除質譜外還有一些其他的方法可以檢測蛋白質的翻譯后修飾,如Western Blot、放射性核素示蹤法、免疫沉淀(IP)等,下表展示了各類實驗方法檢測蛋白質翻譯后修飾的優缺點。
表二、檢測蛋白質翻譯后修飾的各類實驗方法的優缺點
小伙伴們可以根據實際情況進行選擇,如果有合適的抗體的話可以考慮WB或者免疫共沉淀,不差錢的實驗室可以用質譜來檢測。
好了,以上就是本期的內容啦。目前,研究相對成熟的蛋白質翻譯后修飾還僅僅局限于磷酸化、糖基化、乙酰化等10余種修飾,因此蛋白質翻譯后修飾有著廣泛的研究前景,完全揭秘人體內蛋白質的“千變萬化”還需要大家不懈努力,關于視頻版本大家直接點擊《【蛋白質翻譯后修飾】不同類型、機制、功能動畫詳解,含經驗總結;一個視頻幫你梳理清楚》就可以觀看啦~
