

詳細描述巨噬細胞原代培養中細胞分離與培養的具體步驟
 2024-10-24 11:02:17
2024-10-24 11:02:17
來源/作者:普拉特澤-生物醫學整體課題外包平臺
巨噬細胞原代培養中細胞分離與培養的具體步驟由普拉特澤生物為大家總結分享,普拉特澤生物細胞實驗平臺專業承接細胞誘導/分化外包、細胞焦亡等細胞實驗代做服務,積累專業豐富的實驗操作經驗。
在巨噬細胞原代培養中,細胞分離與培養的具體步驟可以細分為以下幾個關鍵環節。以下是根據權威來源整理的詳細步驟:
一、實驗準備
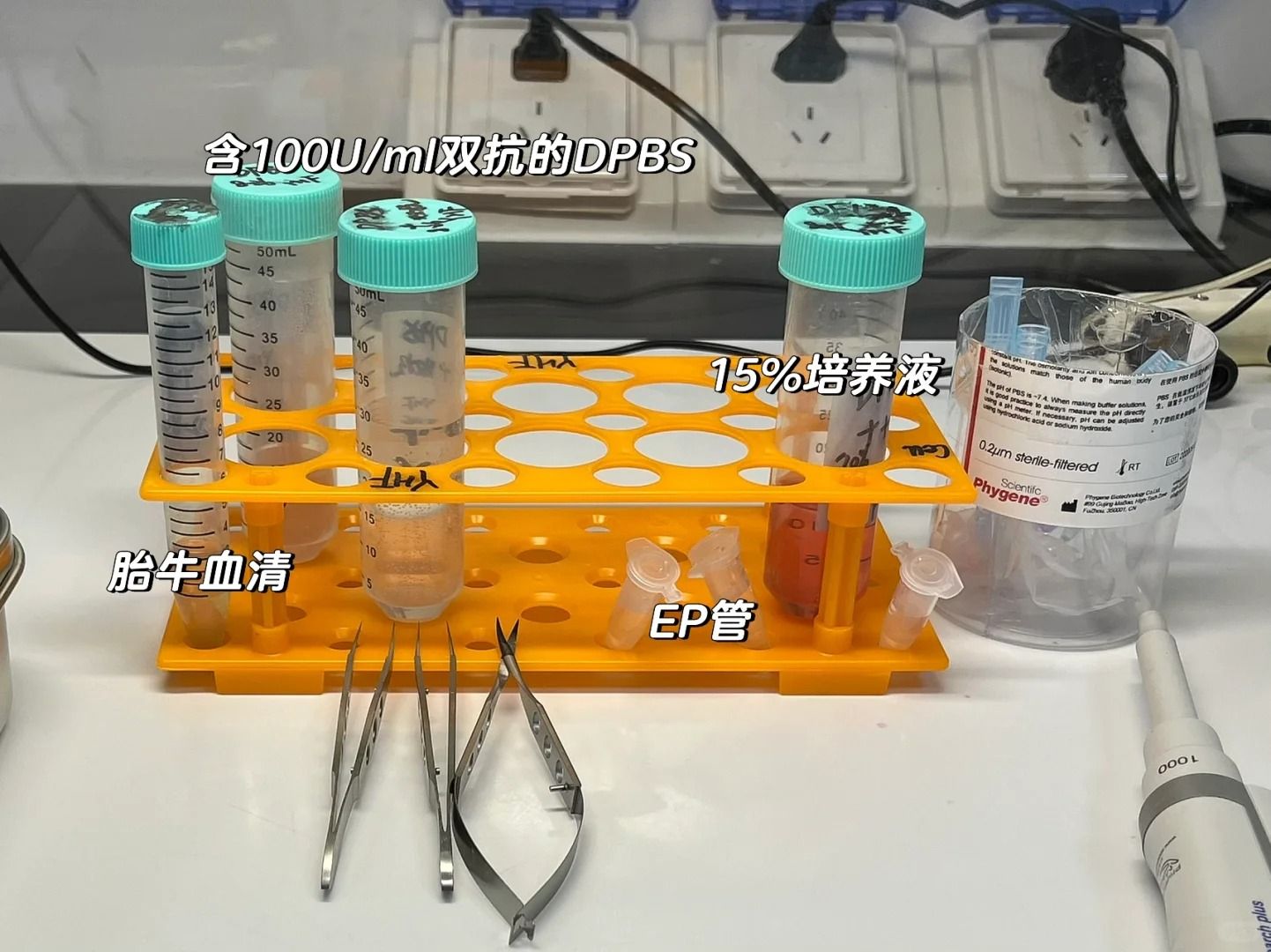
?1. 實驗動物與試劑?
①選擇合適的實驗動物,如SPF級小鼠,體質量通常在18~22g,雄性,6~8周齡。
②準備必要的試劑,包括細胞培養基(如RPMI 1640)、胎牛血清(FBS)、雙抗(抗生素和抗真菌劑)、紅細胞裂解液、PBS(磷酸鹽緩沖液)、以及用于誘導巨噬細胞分化的細胞因子,如M-CSF(巨噬細胞集落刺激因子)。
?2. 實驗器械?
一次性注射器、手術器械(如眼科剪、眼科鑷)、離心管、細胞培養皿、移液槍及槍頭等,并確保所有金屬器械經過高壓滅菌,離心管輻照消毒。

二、細胞分離
腹腔巨噬細胞分離
?1. 腹腔注射刺激物?
在實驗前三天,每天給小鼠腹腔注射1mL的3%巰基乙酸鹽肉湯,以刺激巨噬細胞增殖。
?2. 處死小鼠并收集腹腔液?
⑴采用脫頸法處死小鼠,將小鼠浸泡在75%乙醇中滅菌3-5分鐘,然后移至超凈工作臺。
⑵用預冷的PBS或細胞培養基沖洗腹腔,輕輕按摩小鼠腹部數次,使液體在腹腔內充分流動。
⑶抽取腹腔液,收集至離心管中,并重復沖洗腹腔以增加細胞收集量。
?3. 細胞分離與純化?
⑴將收集的腹腔灌洗液在常溫條件下以1000rpm/min離心10分鐘,棄去上清。
⑵用細胞培養基重懸細胞沉淀,并進行細胞計數。
⑶將細胞懸液接種至細胞培養皿中,置于37℃培養箱中孵育2~3小時,使巨噬細胞貼壁。
⑷棄去未貼壁的細胞,余下的貼壁細胞即為腹腔巨噬細胞。



骨髓巨噬細胞分離
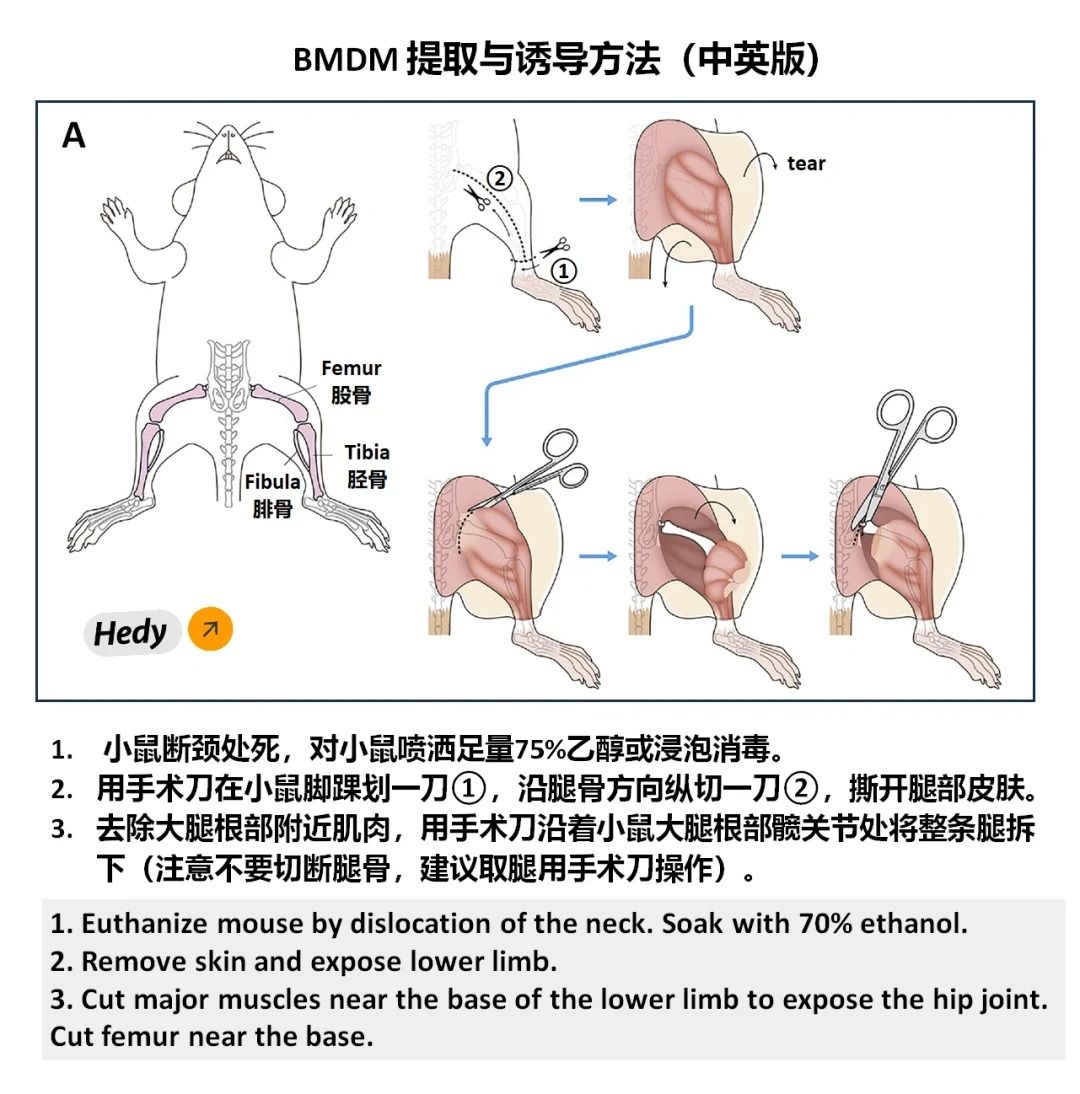
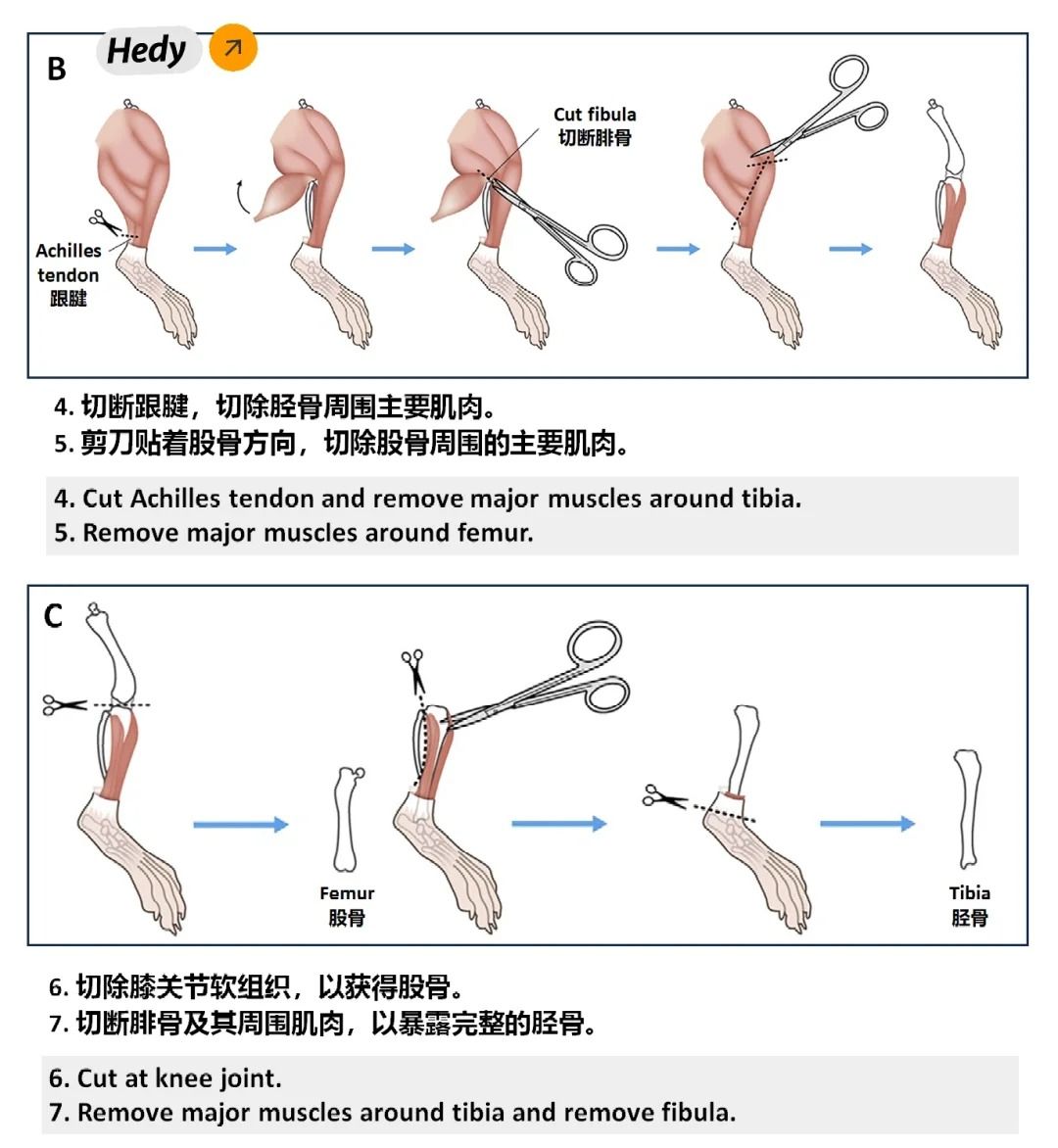
?1. 提取骨髓細胞?
①處死小鼠后,用剪刀和鑷子取出其雙側股骨和脛骨,剔除附著的肌肉和組織。
②將骨骼浸泡在75%乙醇中滅菌后,用冷的PBS清洗。
③使用注射器吸取含有M-CSF的誘導培養基,反復沖洗骨髓腔,收集骨髓細胞懸液。
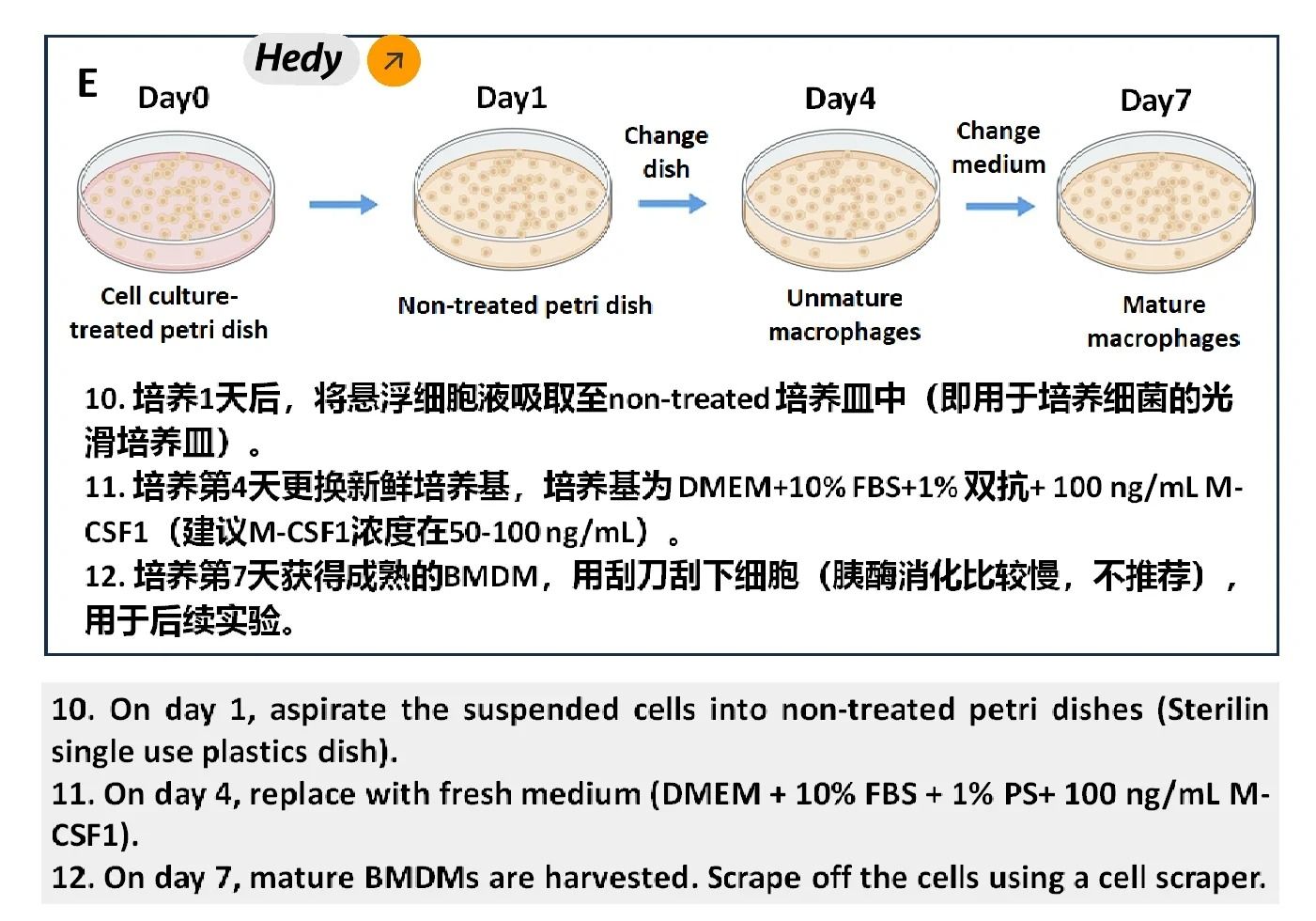
?2. 細胞培養與誘導分化?
①將骨髓細胞懸液過篩后離心,去除紅細胞和雜質。
②用含有M-CSF的誘導培養基重懸細胞,并接種至細胞培養皿中。
③在37℃培養箱中培養,每隔2-3天更換新鮮培養基。
④培養7天后,收集貼壁的骨髓巨噬細胞用于后續實驗。
三、細胞培養
?1. 細胞貼壁與換液?
巨噬細胞貼壁后,需定期更換新鮮的培養基以維持細胞生長環境。
每隔2-3天更換一次培養基,并在更換前用PBS清洗細胞以去除死細胞和雜質。
?2. 細胞形態觀察?
使用倒置顯微鏡定期觀察細胞形態和生長狀態。
巨噬細胞通常呈規則圓形或不規則形狀,貼壁較快且具有較強的吞噬能力。
?3. 細胞計數與活性檢測?
⑴使用細胞計數板對細胞進行計數,并計算細胞活性。
⑵細胞活性檢測通常使用臺盼藍染色法,通過計算活細胞與總細胞的比例來評估細胞活性。
通過以上步驟,可以成功分離并培養出高質量的巨噬細胞原代細胞,為后續的實驗研究提供可靠的細胞來源。
欲獲得更多的信息和幫助,可通過以下方式聯系:
流式檢測|病理檢測|動物模型|實驗服務|分子操作|免疫相關檢測
免費熱線:18570028002

