

原代神經元/干細胞培養鑒定全攻略:突破特殊細胞培養瓶瓶頸
 2025-06-12 17:50:11
2025-06-12 17:50:11
來源/作者:普拉特澤-生物醫學整體課題外包平臺
本文就給小白們從簡介原理分類方法細細講講,梳理夯實一下基礎。
在神經退行性疾病研究與再生醫學領域,原代神經元和干細胞培養是探索細胞機制、藥物篩選及細胞治療的基礎技術。這類特殊細胞對培養環境極為敏感,操作不慎即導致分化異常或細胞死亡。普拉特澤生物將系統解析關鍵操作要點,
掌握核心操作要點,讓脆弱神經細胞與多能干細胞在體外穩定生長,
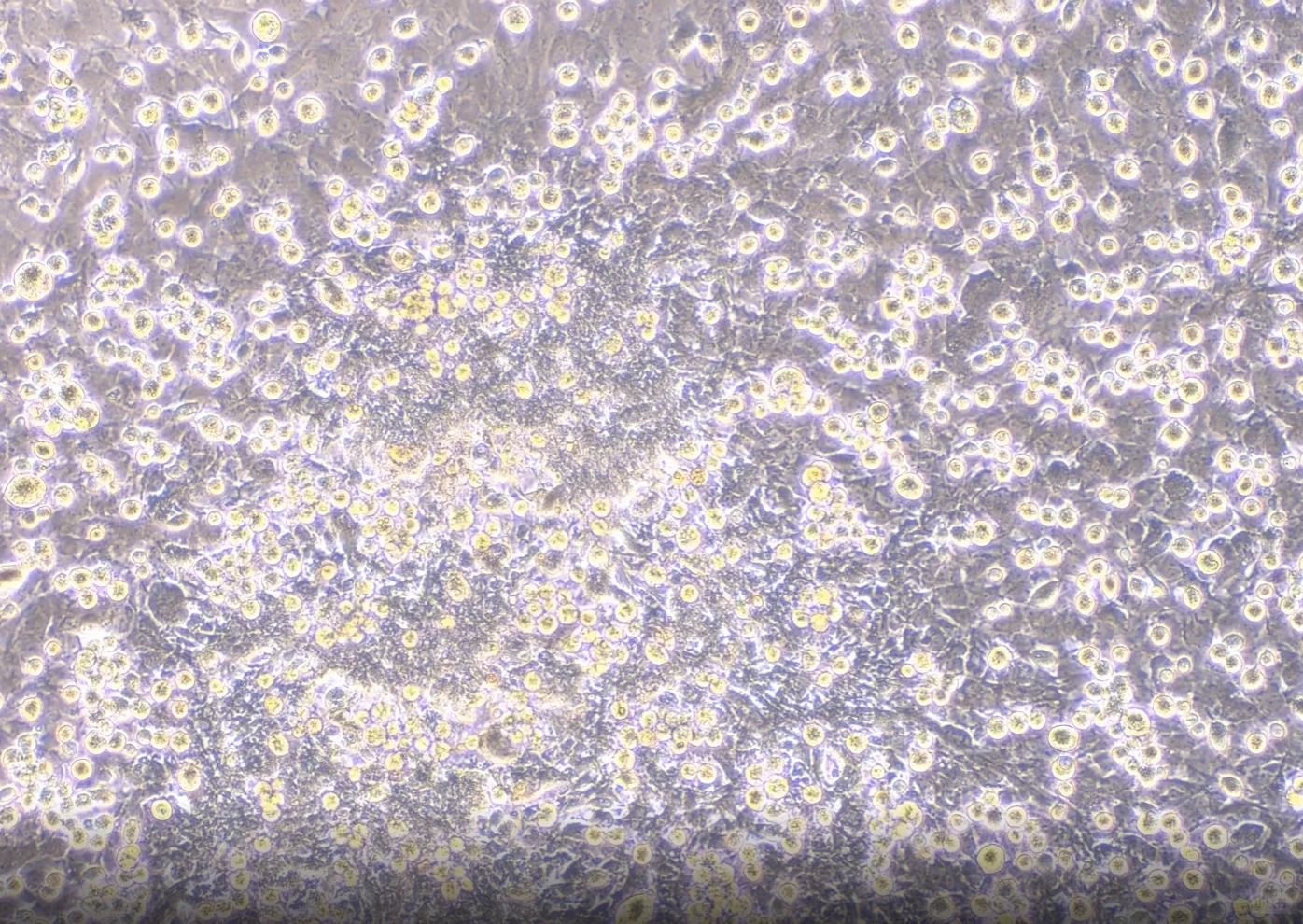
一、精細操作決定成敗
▲取材與分離:時間就是生命
①時效性至上:取產后24小時內的新生鼠海馬或皮層組織,低溫保存勿超24小時。
②酶解優化:采用低濃度胰酶(0.125%) 消化15分鐘,以胎牛血清緊急終止反應,避免過度損傷。
③機械分離技巧:用拋光巴斯德吸管輕柔吹打≤20次,保留細胞完整性。
▲純化與接種:密度決定命運
●差速貼壁除雜:利用成纖維細胞更快貼壁特性(30-60分鐘),轉移未貼壁細胞至新瓶,顯著提升神經元純度。
●精準密度控制:接種密度≥5×10? cells/cm2,確保神經突觸網絡形成;密度不足時神經元易凋亡。
●培養環境定制:模擬體內微環境
●包被基質選擇:多聚賴氨酸(0.1mg/ml)或鼠尾膠原包被培養皿,提供神經元貼壁“錨點”。
●血清替代方案:Neurobasal/B27無血清培養基抑制膠質細胞增殖,維持神經元純度>90%。
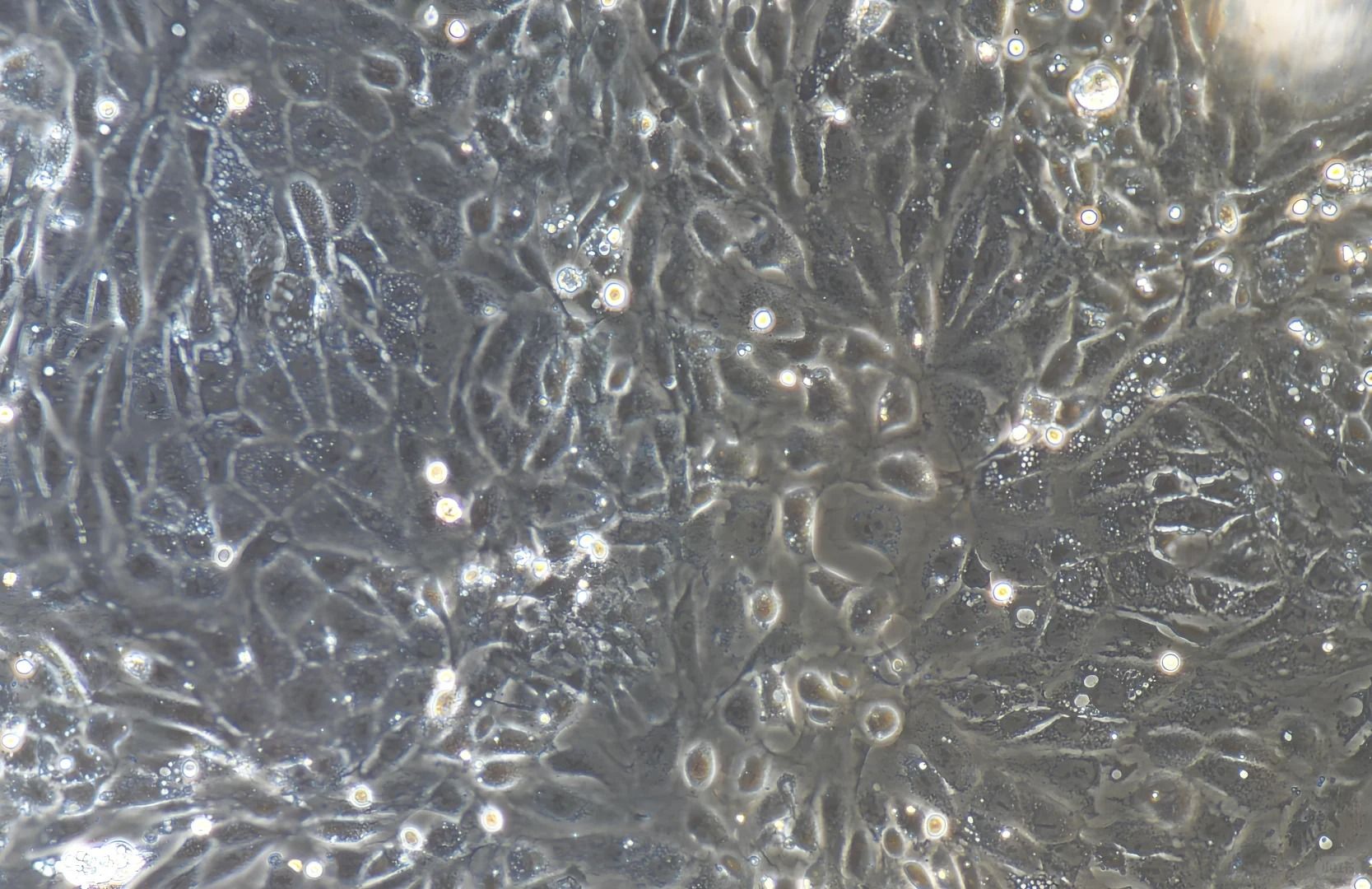
二、干細胞培養
干性維持與防分化
▲胚胎干細胞(ESCs):需飼養層細胞(如經照射的STO成纖維細胞)提供生長支持,添加白血病抑制因子(LIF) 抑制自發分化。
▲間充質干細胞(MSCs):采用低血清培養基(5%FBS),添加bFGF(10ng/ml)促進增殖同時抑制分化。
▲神經干細胞(NSCs):懸浮培養形成神經球,培養基需含EGF/bFGF雙因子,每3天半量換液維持因子濃度。
傳代操作關鍵點
酶消化替代方案:推薦使用溫和消化酶(如Accutase) 替代胰酶,減少膜蛋白損傷。
神經球機械分散:避免酶消化損傷,用火焰拋光的玻璃吸管輕柔吹散神經球。
表:神經元與干細胞培養條件關鍵對比

三、從形態到功能的金標準
▲形態學初判
神經元:培養7天后伸出細長突起,形成網狀連接。
NSCs:原代培養24小時形成2-4細胞神經球,Nestin免疫熒光陽性。
▲免疫表型鑒定
神經元標志物:βIII-tubulin(早期)、MAP2(成熟神經元)、Synaptophysin(突觸形成)。
干細胞干性標志:
ESCs:OCT4+/SSEA-4+(人)、SSEA-1+(鼠)
MSCs:CD90+/CD44+/CD34- 3
功能驗證
電生理檢測:誘導分化21天后神經元應產生動作電位。
多向分化潛能:MSCs經成骨/成脂誘導后,分別以茜素紅/油紅O染色驗證。
四、實戰問題破解:高頻失誤糾正方案
▲細胞貼壁失敗
根源:包被不足或血清含量低
對策:膠原包被(0.1mg/ml),接種后靜置3-5小時再補液
▲神經球分化率低
根源:生長因子緩釋不足
創新方案:采用殼聚糖納米載體負載NGF,緩釋72小時,分化效率提升至78.3%(傳統法僅41.2%)
干細胞早衰
▲根源:傳代過度或密度不當
黃金標準:貼壁達90%即傳代,接種密度保持1×10? cells/cm2
培養基更換后漂浮細胞增多
溫度休克預防:培養基必須預熱至37℃,避免冷刺激致細胞收縮脫落
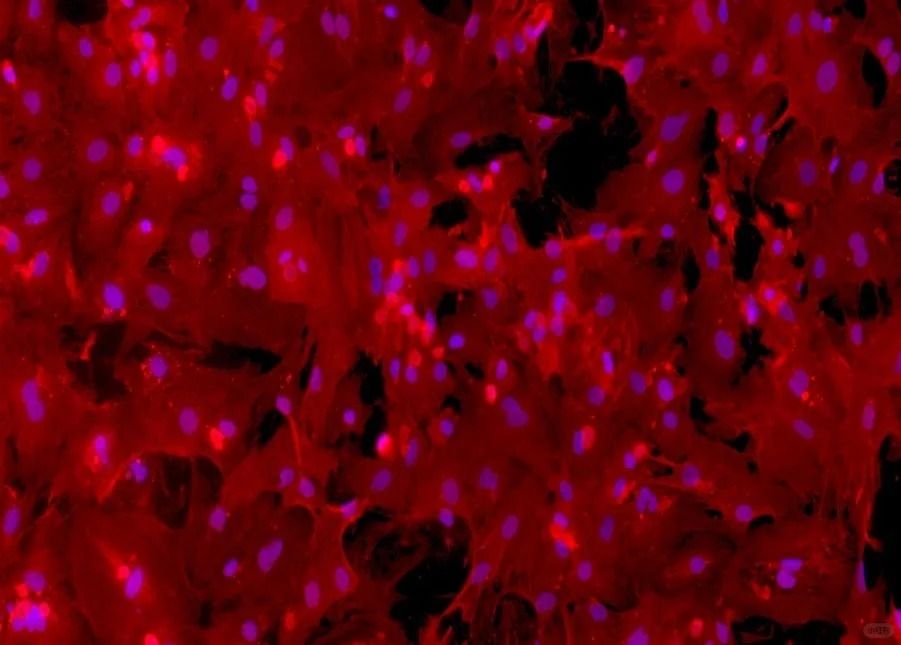
五、提升培養效率
殼聚糖-NGF納米顆粒:粒徑147nm的緩釋系統,結合BDNF構建誘導體系,顯著提升ADMSCs向功能性神經元分化效率。
無血清培養基革新:避免動物源成分,添加人源血小板生長因子(hPDGF),降低批間差并支持臨床應用。
原代神經元與干細胞培養的成功,建立在三大基石之上:嚴格的時間控制(取材至接種的時效)、精確的微環境模擬(生長因子組合及基質包被),以及規范的無菌操作。
每一步操作的精細度,直接決定了細胞狀態與實驗數據的可靠性。
隨著緩釋載體技術與無血清培養基的迭代,未來這些特殊細胞的培養將逐步突破效率瓶頸,為神經再生與器官構建研究提供更強大的技術支撐。
普拉特澤,堅持提供真實、完整、唯一原始數據、原始圖片。
普拉特澤生物,自有專業動物房、造模實驗室,配套設備齊全,技術團隊成熟,熟練掌握各類動物模型構建,更有細胞、分子、病理平臺,一站式解決后續相關實驗檢測。請點擊細胞實驗平臺了解詳情,或者直接掃碼↓↓↓

