

相關實驗
實驗承諾函
咨詢記錄
技術文章

城市
時間
江蘇省南通市
2025-09-06 01:46:58
北京市
2025-09-05 21:58:30
北京市
2025-09-05 17:44:03
北京市
2025-09-05 17:43:54
江蘇省南通市
2025-09-05 17:43:46
江蘇省南通市
2025-09-05 17:43:42
江蘇省南通市
2025-09-05 17:43:42
北京市
2025-09-05 17:43:37
江蘇省南通市
2025-09-05 17:43:20
江蘇省蘇州市
2025-09-05 17:14:59
線粒體介紹
線粒體除了作為細胞內能量生成的關鍵細胞器,還參與細胞凋亡、自由基生產、脂質代謝等代謝過程。一些研究報道指出,線粒體功能異常會導致許多常見疾病的病理,包括神經退化、代謝疾病,心臟衰竭,缺血再灌注損傷和原生動物的感染等。因此,線粒體是這些高度流行疾病的一個重要藥物靶點。一些旨在治療性恢復線粒體功能的策略正在出現,少數藥物已進入臨床試驗。
1.能量轉化 :線粒體是真核生物進行氧化代謝的部位,是糖類、脂肪和氨基酸最終氧化釋放能量的場所。線粒體負責的最終氧化的共同途徑是三羧酸循環與氧化磷酸化,分別 對應有氧呼吸的第二、三階段。
2.三羧酸循環 :糖酵解中生成的每分子丙酮酸會被主動運輸轉運穿過線粒體膜。進入線粒體基質后,丙酮酸會被氧化,并與輔酶A結合生成CO2、還原型輔酶Ⅰ和乙酰輔酶A
3.氧化磷酸化 :NADH和FADH2等具有還原性的分子在電子傳遞鏈里面經過幾步反應最終將氧氣還原并釋放能量,其中一部分能量用于生成ATP,其余則作為熱能散失。在線 粒體內膜上的酶復合物(NADH-泛醌還原酶、泛醌-細胞色素c還原酶、細胞色素c氧化酶)利用過程中釋放的能量將質子逆濃度梯度泵入線粒體膜間隙。雖然這一過程是高 效的,但仍有少量電子會過早地還原氧氣,形成超氧化物等活性氧(ROS),這些物質能引起氧化應激反應使線粒體性能發生衰退。在此過程中產生的ROS和一些中間代謝 物可作為線粒體的信號,調節相關下游反應;ROS也可能會對線粒體造成氧化損傷;ROS與線粒體內富集的Ca2+共同作用于MTPTP,會致使線粒體腫脹,細胞死亡。
4.儲存鈣離子 :線粒體可以儲存鈣離子,可以和內質網、細胞外基質等結構協同作用,從而控制細胞中的鈣離子濃度的動態平衡。線粒體迅速吸收鈣離子的能力使其成為細胞 中鈣離子的緩沖區。在線粒體內膜膜電位的驅動下,鈣離子可由存在于線粒體內膜中的單向運送體輸送進入線粒體基質;排出線粒體基質時則需要鈉-鈣交換蛋白的輔助或 通過鈣誘導鈣釋放(calcium-induced-calcium-release,CICR)機制。
5.其他功能 :除了合成ATP為細胞提供能量等主要功能外,線粒體還承擔了許多其他生理功能:調控細胞程序性死亡;線粒體膜通透性增加也能使誘導凋亡因子(AIF)等分 子釋放進入細胞質基質,破壞細胞結構;細胞增殖與細胞代謝的調控;合成膽固醇及某些血紅素 。
線粒體與疾病的關系
當流向器官的血液被打斷時,就會發生缺血,使器官失去氧氣和外部代謝物的供應,導致乳酸、琥珀酸的堆積。此時含氧血液再灌注入器官,會導致琥珀酸氧化,產生ROS,致使氧化損傷。且同時ROS與線粒體內富集的Ca2+共同作用于MTPTP,會致使線粒體腫脹,細胞死亡,從而引發炎癥(如圖1)。
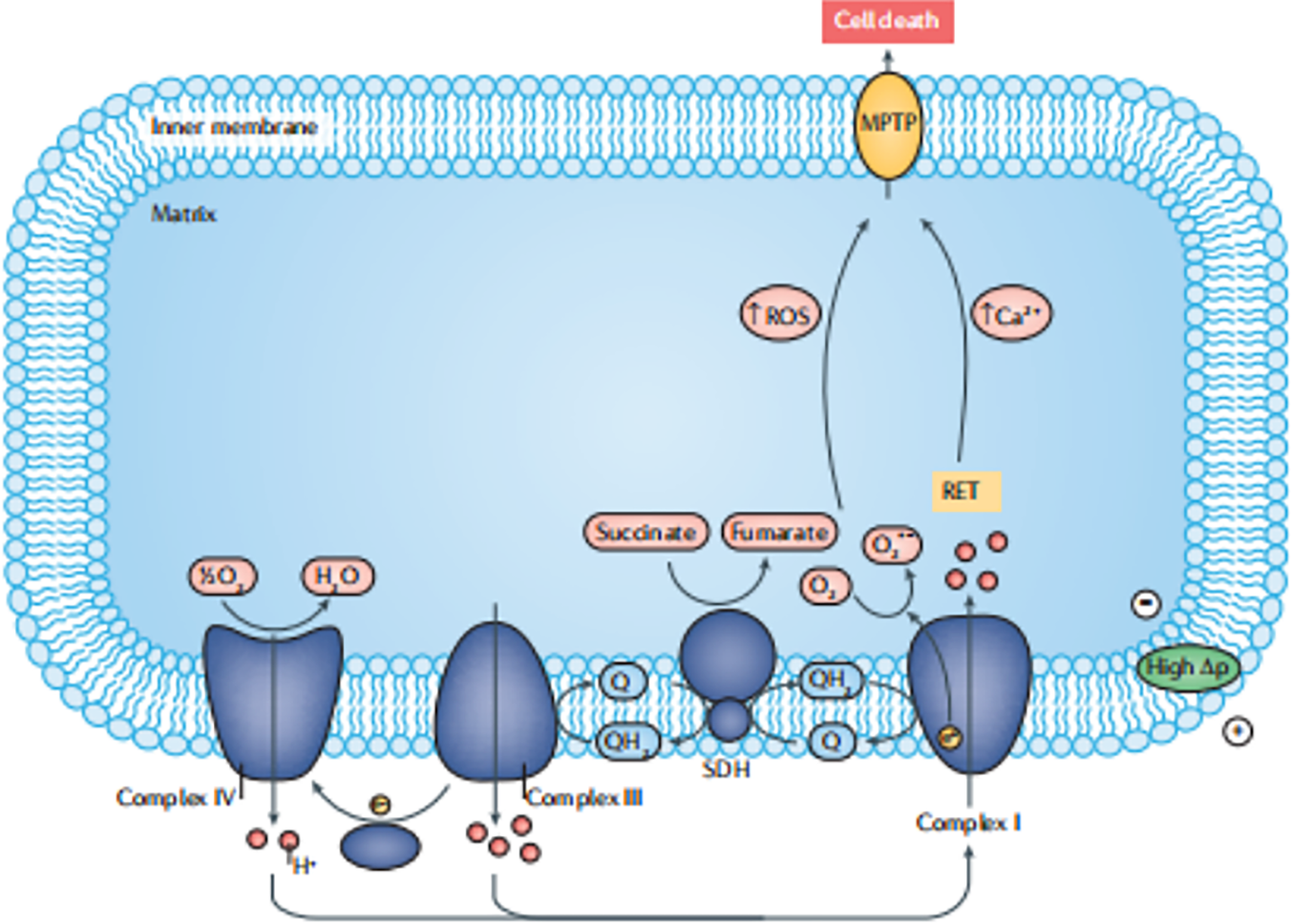
圖1 線粒體功能及相關病理(來自文獻)
減肥是一個相當熱門的話題,通過線粒體,促進脂肪代謝來提供能量,能夠有效的治療肥胖。細胞的線粒體中會產生三磷酸腺苷(ATP)分子,它能夠為身體提供能量。 Tips:20世紀30年代曾經流行過一種減肥藥——2,4-二硝基苯酚(DNP),它會阻斷這一過程,導致線粒體產生熱量而非ATP,并促使細胞代謝碳水化合物和脂肪。后來多人由于過熱死亡,DNP在1938年被廢止使用。近來有研究發現,DNP甲基醚能在肝臟中被代謝為DNP,從而減少脂肪肝與高血脂的癥狀。
即不能正常降低血糖。 Tips:可以通過線粒體為靶點的治療手段有:使用二甲雙胍,抑制氧化磷酸化過程中的復合物I,使ADP:ATP 的比值上調,從而激活AMPK,延緩肝臟糖異生的反應;通過NMN,使NAD+水平上調,改善II型糖尿病;通過減少線粒體ROS的生成,或使用抗氧化劑,恢復胰島素,且減少糖尿病并發癥。
線粒體內的超氧化物與血管舒張劑NO反應,導致血管收縮,造成高血壓;或ROS導致細胞外彈性蛋白酶被氧化損傷,從而會導致高血壓。 Tips:有研究表明,利用抗氧化劑MitoQ有望通過阻止ROS損傷來治療高血壓。
非酒精性脂肪肝(NAFLD)是與肥胖相關的疾病,NAFLD的治療選擇有限,肝移植是肝硬化的唯一可能。但脂肪在肝臟的積累是NAFLD的關鍵驅動因素,這可以通過DNP衍生物誘導肝內線粒體選擇性解耦從而增強線粒體脂肪氧化從而解決。 Tips:線粒體損傷與NAFLD的發展密切相關,氧化應激升高,NAD+耗竭。可通過抗氧化劑MitoQ及NMN補充NAD+,作為一種治療手段。
亨廷頓病、家族性帕金森病、阿爾茨海默病、肌萎縮性脊髓側索硬化癥等疾病被認為是與線粒體損傷相關的疾病。許多類型的線粒體功能障礙與神經退行性變有關,包括氧化損傷、ATP合成缺陷、NAD+耗盡、線粒體動力學和質量控制受限、鈣穩態紊亂。可以通過對這些方面的調節作為一種治療手段。
視網膜感光細胞(RPCs)受損或喪失是西方國家最常見的視力喪失原因,依賴于氧化磷酸化和高水平的氧化應激使視網膜非常容易受到線粒體功能障礙的影響,這表明專注于這個細胞器的治療是有益于視網膜功能性障礙的改善的。 Tips:動物模型的研究結果支持了這一觀點,即RPC死亡與NAD+耗竭有關,導致SIRT3活性下降, 通過NMN補充NAD+能減少這種細胞的損失。
心臟供血需要能量,它依靠線粒體ATP的產生來驅動心肌細胞收縮,并重新分配釋放的鈣來啟動這一過程。因此,線粒體功能障礙是心衰的一個關鍵組成部分。 Tips:導致心力衰竭與線粒體功能障礙相關的因素有多種,但ROS的產生升高、氧化損傷、線粒體生物發生缺陷是最為常見的,機制尚不清楚,且通過抗氧化劑的臨床效果不佳。寄希望于保護線粒體或增加線粒體作為目標的治療,是未來發展的領域。
原生動物感染導致了許多醫學、社會和經濟上的重要疾病,包括瘧疾、布魯氏錐蟲和查加斯病(克魯茲錐蟲)。由于缺乏疫苗、藥物毒性和出現耐藥性,研制治療這類寄生蟲病的新療法是一個迫切需要得到滿足的領域。原生動物線粒體是一個有吸引力的藥物靶點,因為它們的線粒體不僅對生存至關重要,而且與哺乳動物宿主的線粒體也有很大的不同。
靶向線粒體的治療方案
線粒體能量代謝的紊亂會導致多種“繼發性”線粒體疾病,線粒體導致疾病的常見原因有:
1.ATP:ADP的比率下降,NAD+的量下降,導致信號通路改變;
2.代謝紊亂;
3.產生大量ROS,導致氧化損傷;
4.誘導MPTP通路,使細胞凋亡或死亡;
5.鈣離子通道異常(如圖3)。
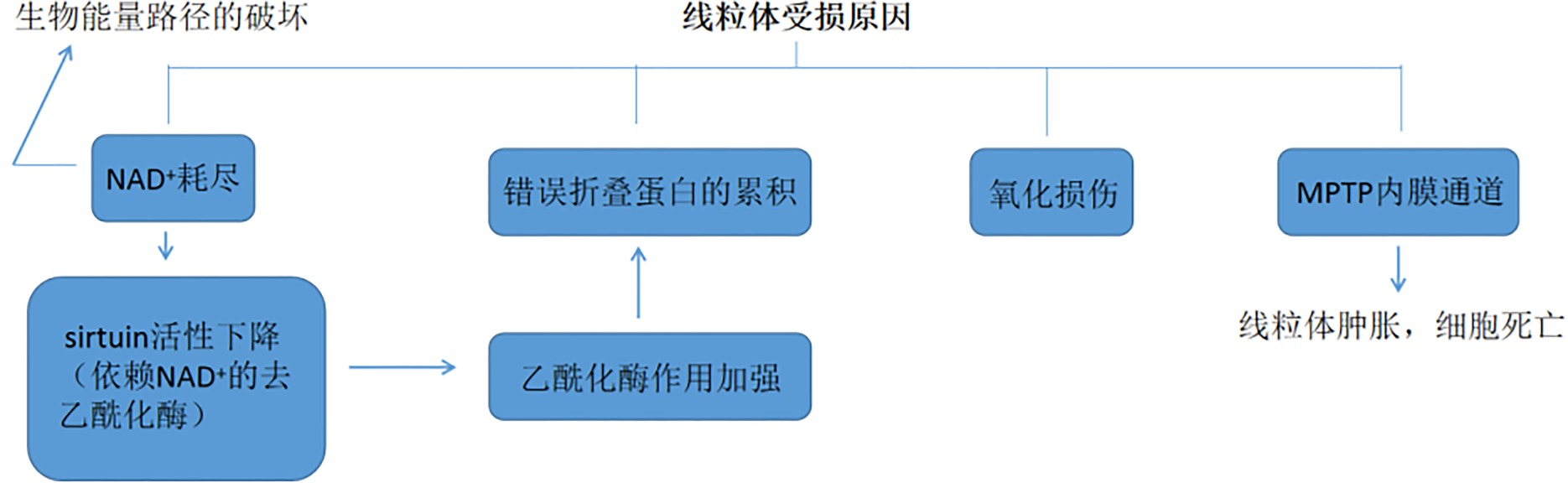
圖3 線粒體受損的常見原因
其相對應的靶向線粒體的治療方案:
1.補充NAM、NMN等來補充NAD+;
2.激活蛋白酶,伴侶蛋白,協助蛋白正確折疊;
3.使用抗氧化劑(S1QELS/S3QELS分別與呼吸鏈復合酶I/復合酶II結合,抑制ROS生成);
4.使用CsA,阻止MPTP通道引起的細胞凋亡或死亡。
以上幾個治療方案是機動聯合的,對其中一種進行調節,其他情況均會有所改善。
研究線粒體功能的技術手段
非直接影響線粒體,而是通過增加線粒體數量與活性,進而增加內膜表面積,增加ATP的產生。 利用PPCIα蛋白相關調控機制,來調節線粒體的數量。PGCIα能結合調控NRF1/NRF2、ERRS、CRER1、FOXO、PPAR等多種蛋白。其中NRF1/NRF2能夠調控表達多種多肽靶向線粒體,eg:POCG(DNA聚合酶)、DNA解旋酶,其對線粒體分裂生成十分關鍵。研究表明比格列酮、羅格列酮等抗糖尿病藥物,可激活PPAR從而增加PGCIα表達上調,致使線粒體數量增多。另外,使用SIRT1活化劑通過去乙酰化激活PGCIα,從而增多線粒體數量。或者通過抑制線粒體合成抑制通路,增加線粒體數量,如低氧誘導因子。
為適應不同生理功能,細胞內不同區域能量需求不同,線粒體通過分裂和融合的方式,動態變化適應機體需求。 當分裂速率>融合速率,則線粒體數量增加;融合速率>分裂速率,則線粒體數量減少,體積增大。其中Drp1、Fis1酶參與線粒體分裂過程,而Mfn1、Mfn2參與線粒體外膜融合,OPA1參與線粒體外膜融合。可以通過調節分裂融合相關蛋白,來調節線粒體的數量,作為一種治療手段。
加強對線粒體質量的把控可通過增加線粒體自噬的手段來實現,研究表明增強線粒體分裂的藥物可能會增加受損細胞器的清除,增加自噬,減少炎癥的發生,一種較好的治療策略。
線粒體是細胞凋亡與死亡調控過程中的核心部分,其很多特性使其可作為靶點,致死癌細胞、寄生蟲。其缺陷是可能導致無選擇性的殺死正常細胞。 要利用正常細胞與需致死細胞中線粒體之間的差異部分,作為靶點,結合抗癌藥物進行治療;或者通過耗盡抗氧化劑、增加ROS產量,使細胞氧化損傷,從而致死。
線粒體能向細胞其他部分發出信號,如ATP/ADP、ca2+、NAD+、ROS、代謝物等,如ROS是作為氧化還原反應的信號,調節這些信號也可能成為一種治療手段。
